Đề kiểm tra tự luận học kì 1 môn Hóa học 10 trường THPT Bình Hưng Hòa TP.HCM
SỞ GD – ĐT TP HỒ CHÍ MINH ĐỀ KIỂM TRA HỌC KÌ I NĂM HỌC 2020 – 2021
Trường THPT Bình Hưng Hòa Môn HÓA : Lớp 10
Thời gian làm bài : 45 phút, không kể thời gian phát đề
ĐỀ CHÍNH THỨC
(Đề kiểm tra gồm 1 trang)
Câu 1 (2 điểm) Viết cấu hình electron của nguyên tử và xác định vị trí (Ô, chu kì, nhóm) trong BTH và cho biết tính chất hóc học cơ bản (kim loại, phi kim, khí hiếm) trong các trường hợp sau (không giải thích)
- X có phân lớp electron ngoài cùng là 3p5
- Y có điện tích hạt nhân là 29+
Câu 2 (2,0 điểm)
- Viết sơ đồ giải thích sự hình thành liên kết ion trong hợp chất Na2O
- Viết công thức electorn và công thức cấu tạo của PH3, C2H2
Câu 3 (1 điểm) Cho Na (Z = 11); Mg(Z = 12); Al (Z = 13)
- Sắp sếp các nguyên tử trên theo chiều tính kim loại tăng dần (không giải thích)
- Sắp xếp theo chiều tính bazo tăng dần của các hidroxit tạo từ các kim loại trên (không giải thích)
Câu 4 (2 điểm) Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron
- C + HNO3 ® NO2 + CO2 + H2O
- K2Cr2O7 + HCl ® KCl + CrCl3 + Cl2 + H2O
Câu 5 (2,0 điểm) Hợp chất oxit cao nhất của nguyên tố R có công thức là RO3. Trong công thức hợp chất khí với hidro của R có chứa 5,88% hidro về khối lượng.
- Xác định nguyên tố R. Cho biết công thức hidroxit cao nhất của R.
- Cho 100g dung dịch hidroxit cao nhất trên với nồng độ 19,6% tác dụng với 100g dung dịch NaOH 4%. Tính nồng độ % dung dịch muối thu được.
Câu 6 (1,0 điểm) Bo có hai đồng vị, mỗi đồng vị đều có 5 proton. Đồng vị thứ nhất có số proton bằng số nơtron. Đồng vị thứ hai có số nơtron bằng 1,2 lần số proton. Biết nguyên tử khối turng bình của Bo là 10,812. Tính % mỗi đồng vị
đề thi học kì 2 môn Hóa lớp 10 của các trường THPT HCM năm 2016
ĐỀ SỐ 1: TRƯỜNG THPT BÙI THỊ XUÂN
1: Thực hiện chuỗi phản ứng sau (điều kiện):
KMnO4 → Cl2 → Br2 → KBr → K2SO4 → KCl → KOH → KClO3 → O2
2: Nêu hiện tượng và viết phương trình phản ứng xảy ra khi:
a) Cho H2SO4 đặc, dư vào ống nghiệm chứa đường saccarozơ, dẫn khí thoát ra vào dung dịch KMnO4.
b) Đun nóng dung dịch H2SO4 đặc với muối Na2SO3, dẫn khí sinh ra qua dung dịch Axit sunfuahiđric.
3: Viết phương trình phản ứng chứng minh:
a) Lưu huỳnh có tính khử.
b) Khí sunfurơ có tính oxi hóa.
c) Axit clohiđric có tính oxi hóa.
d) H2S có tính khử mạnh.
e) Axit sunfuahiđric đặc có tính oxi hóa mạnh.
f) Ozon có tính oxi hóa mạnh hơn oxi.
4: Cho hỗn hợp X gồm Fe, Cu tác dụng với m gam dung dịch H2SO4 20% loãng (dùng dư 10% so với lượng phản ứng) thu được 2,24 lít khí Hiđro (đktc). Mặt khác nếu cho lượng hỗn hợp X trên tác dụng với dung dịch H2SO4 đặc, nguội, dư thu được 3,36 lít khí (đkc).
a) Viết phương trình hóa học và tính % theo khối lượng mỗi kim loại trong hỗn hợp X?
b) Tính m?
5: Hòa tan hoàn toàn 7,68 gam kim loại M với H2SO4 đặc, nóng, dư. Sau khi phản ứng kết thúc thu được 2,688 lít khí SO2 (đkc).
a) Xác định tên kim loại M?
b) Dẫn toàn bộ lượng khí SO2 sinh ra ở trên hấp thụ hoàn toàn vào 200ml dung dịch NaOH 8% (d = 1,25 g/ml). Tính C% của các chất trong dung dịch sau phản ứng?
ĐỀ SỐ 2: TRƯỜNG THPT TÂY THẠNH
1: Hoàn thành các phương trình phản ứng sau (cân bằng và ghi rõ điều kiện):
a) ZnO + HCl loãng
b) SO2 + O2
c) KOH + H2S (tỉ lệ 1:1)
d) KBr + H2SO4 đặc, nóng
e) NaI + AgNO3
f) CaF2 rắn + H2SO4 đặc
2:
a) Cho 60 gam kẽm bột vào cốc đựng dung dịch H2SO4 1M ở nhiệt độ phòng. Tốc độ phản ứng thay đổi như thế nào khi thay 60 gam kẽm bột bằng 60 gam kẽm hạt. Giải thích?
b) Xét hệ cân bằng trong một bình kín: C® + H20(k) → CO(k) + H2(k) ΔH >0
Cân bằng sẽ chuyển dịch như thế nào (giải thích ngắn gọn) khi:
+ Tăng áp suất chung của hệ.
+ Tăng nhiệt độ của hệ.
3:
a) Viết hai phương trình phản ứng chứng tỏ rằng lưu huỳnh có tính oxi hóa và tính khử.
b) Nhận biết các dung dịch trong các lọ mất nhãn sau bằng phương pháp hóa học: Na2SO3, Na2SO4, NaCl, NaNO3.
4: Dẫn 6,72 lít khí SO2 (đktc) vào 600 ml dung dịch NaOH 1M. Tính khối lượng muối thu được sau phản ứng.
5: Cho 5,31 gam hỗn hợp gồm Al và Mg tác dụng với dung dịch H2SO4 đặc, nóng, dư thu được 5,712 lít khí SO2 (đktc) là sản phẩm khử duy nhất của phản ứng. Tính % khối lượng Al trong hỗn hợp đầu.
6: Cho cân bằng : N2(k) + 3H2(k) → 2NH3(k) . Tỉ khối hơi của các chất đối với hidro có giá trị là x. Khi tăng nhiệt độ thì tỉ khối hơi của hệ so với hiđro bằng y. Biết rằng x > y. Hãy biện luận để biết được đây là phản ứng thu nhiệt hay phản ứng tỏa nhiệt.
ĐỀ SỐ 3: TRƯỜNG THPT GÒ VẤP
1: Thực hiện chuỗi phản ứng sau (điều kiện):
Fe → FeS → H2S → SO2 → H2SO4 → CuSO 4 → BaSO4 →
Na 2SO3 → SO2
2: Không dùng quỳ tím hãy trình bày phương pháp hóa học để nhận biết các dung dịch sau:
Na2S, Nacl, K2SO4,BaCl2. Viết phương trình phản ứng minh họa nếu có
3. Xét hệ cân bằng sau:![]() Cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau:
Cân bằng trên chuyển dịch như thế nào khi biến đổi một trong các điều kiện sau:
a) Giảm nhiệt độ của hệ.
b) Thêm khí CO.
c) Lấy bớt khí H2
d) Tăng áp suất chung của hệ.
4:
a) Bằng phản ứng trực tiếp hãy viết 2 phương trình khác nhau để điều chế khí Oxi?
b) Từ quặng Pirit sắt, nước và không khí. Viết phương trình phản ứng điều chế muối sắt
(III) sunfat?
5: Cho 17,6 gam hỗn hợp Cu, Fe tác dụng với dung dịch H2SO4 loãng – dư, thu được 4,48
lít khí (đkc). Mặt khác, cũng lượng hỗn hợp 2 kim loại trên tác dụng với dung dịch H2SO4 đặc – nóng – dư, thu được V lít khí SO2 (đkc).
a) Tính % khối lượng mỗi kim loại trong hỗn hợp?
b) Tính V?
c) Dẫn khí SO2 thu được ở trên vào 150ml dung dịch NaOH 1M. Tính khối lượng muối thu được?
ĐỀ SỐ 4: TRƯỜNG THPT NAM KỲ KHỞI NGHĨA
1: Viết phương trình hóa học thực hiện dãy chuyển hóa sau (ghi rõ điều kiện nếu có):
2: Có 3 chất khí X, Y, Z được điều chế từ những chất sau: K2CO3, Zn, Cu, H2SO4 đặc, H2SO4 loãng. Biết:
a) Khí X nặng hơn không khí và không duy trì sự cháy.
b) Khí Y nhẹ hơn không khí và cháy được trong không khí.
c) Khí Z nặng hơn không khí và khí Z vừa có tính oxi hóa vừa có tính khử.
Tìm tên của các khí X, Y, Z và viết các phương trình phản ứng.
3:
1) Có 4 dung dịch không màu được đựng riêng trong các lọ mất nhãn: KCl, K2SO4, KOH,
BaCl2. Hãy phân biệt mỗi dung dịch trên bằng phương pháp hóa học.
2) Hãy nêu hiện tượng và viết phương trình phản ứng xảy ra khi:
a) Sục khí Cl2 vào dung dịch KBr.
b) Dẫn khí SO2 vào dung dịch axit sunfuhiđric H2
4: Viết phương trình hóa học hoàn thành các phản ứng sau (mỗi chỗ trống chỉ điền một chất):
a) Mg + ……… ® MgSO4 + ………
b) …….. + HCl ® CuCl2 + ………
c) H2SO4 + ……… ® FeSO4 + SO2 + H2O
d) Cho SO2 đến dư vào dung dịch KOH
e) Đốt cháy Fe trong khí Clo
f) H2S + ……… ® ……… + HCl
5: Hòa tan hoàn toàn m gam hỗn hợp X gồm Fe và Zn trong dung dịch H2SO4 đặc, nóng người ta thu được dung dịch có chứa a gam hỗn hợp muối và 4,48 lít SO2 (đktc). Mặt khác, nếu đem m gam hỗn hợp X trên tác dụng với dung dịch HCl thì cần vừa đủ 200 ml dung dịch HCl 1,5M.
a) Tìm giá trị của m, a.
b) Để pha loãng dung dịch H2SO4 đặc trên ta nên cho axit vào nước hay nước vào axit?
ĐỀ SỐ 5: TRƯỜNG THPT TRẦN HỮU TRANG
1: (2đ) Hoàn thành chuỗi phản ứng sau, ghi rõ điều kiện phản ứng nếu có:
2: (2đ) Nhận biết các dung dịch sau đây bằng phương pháp hóa học:
K2S, NaCl, K2SO4, KNO3, NaOH.
3: (2đ) Viết các phương trình sau nếu có:
a) Nung hỗn hợp bột nhôm và lưu huỳnh.
b) Cho dung dịch H2SO4 loãng vào lá đồng.
c) Thổi khí SO2 vào dung dịch Brom.
d) Đốt cháy C2H4O2.
e) Cho dung dịch H2SO4 đặc vào đồng (II) oxit.
4: (2đ) Hấp thụ 2,24 lít khí SO2 vào 100ml dung dịch NaOH 1,8M.
a) Tìm khối lượng các muối thu được.
b) Tìm nồng độ mol/lit các chất trong dung dịch sau phản ứng (thể tích dung dịch không đổi).
5: (2đ) Có 10,4 gam hỗn hợp Mg, Fe tác dụng với 1000 gam dung dịch H2SO4 đặc nóng thu được 7,84 lít khí ở đktc.
a) Tìm khối lượng mỗi kim loại trong hỗn hợp đầu.
b) Tìm nồng độ % mỗi muối trong dung dịch sau phản ứng.
ĐỀ SỐ 6: TRƯỜNG THPT NGUYỄN HIỀN
1: (1,5đ) Bổ túc đầy đủ chuỗi phản ứng kèm theo điều kiện nếu có:
KMnO4 → O2 → SO2 → SO3 → H2SO4 → H2S → KHS
2: (1đ) Viết phương trình phản ứng chứng minh:
a) Ozon có tính oxi hóa mạnh hơn oxi.
b) H2SO4 đặc nóng oxi hóa được phi kim.
3: (1,5đ) Trình bày phương pháp hóa học nhận biết các dung dịch riêng biệt mất nhãn sau:
Na2SO4, K2SO3, NaNO3, BaCl2.
4: (1đ) Từ nguyên liệu chính là bột sắt, axit clohiđric và bột lưu huỳnh hãy trình bày 2 phương pháp điều chế hiđrosunfua bằng phương trình phản ứng.
5: (1đ) Cho FeO vào dung dịch H2SO4 loãng dư thu được dung dịch A. Thêm từ từ đến dư dung dịch KMnO4 vào dung dịch A. Viết các phương trình phản ứng.
6: (1đ) Xét hệ cân bằng sau trong một bình kín:
Cân bằng này dịch chuyển theo chiều nào khi:
a) Rút bớt Na2CO3
b) Tăng nhiệt độ
c) Giảm áp suất
d) Thêm chất xúc tác
7: (2đ) Cho 11,28 gam hỗn hợp gồm Mg, Fe tác dụng với dung dịch có x mol H2SO4 đặc, nóng (dư 10% so với lượng phản ứng) thu được 7,728 lít SO2 đktc (sản phẩm khử duy nhất).
Tính x?
8: (1đ) Cho 7,2 gam kim loại M hóa trị II không đổi phản ứng hoàn toàn với hỗn hợp khí Cl2, O2. Sau phản ứng thu được 23 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (đktc). Xác định kim loại M.
ĐỀ THI HỌC KÌ 1 HÓA 10
ĐỀ THI HỌC KỲ 1 HÓA HỌC 10, TRƯỜNG THPT MARIE CURIE, QUẬN 3, TPHCM, NĂM 2017-2018
Câu 1: (1 điểm) Cho nguyên tử oxi (O) có số Z = 8.
- a) Viết cấu hình eletron nguyên tử oxi.
- b) Dựa vào cấu hình electron nguyên tử hãy xác định vị trí của oxi trong bảng tuần hoàn các nguyên tố hóa học.
Câu 2: (1 điểm) Cho nguyên tử Mg (magie) có cấu hình electron lớp ngoài cùng là 3s2 và tổng số hạt mang điện bằng số khối.
- a) Xác định số khối của nguyên tử magie.
- b) Viết ký hiệu nguyên tử magie.
Câu 3: (2 điểm)
- a) So sánh tính kim loại giữa nguyên tố Beri (Be) và nguyên tố liti (Li). Giải thích.
- b) So sánh tính kim loại giữa nguyên tố natri (Na) và nguyên tố liti (Li). Giải thích.
- c) Sắp xếp các nguyên tố Be, Na, Li theo chiều tính kim loại tăng dần.
Câu 4: (1 điểm) Viết phương trình phản ứng hóa học có biểu diễn chiều dịch chuyển electron và ghi điện tích của các ion trong hợp chất tạo thành khi cho nhôm (Al) tác dụng với Clo (Clo). Cho biết Al (Z = 13), Cl (Z = 17).
Câu 5: (1 điểm) Theo quy tắc bát tử, hãy viết công thức cấu tạo của các hợp chất sau: HCl, SO3.
Câu 6: (1 điểm) Ta có phương trình phản ứng hóa học sau:
K2Cr2O7 + HBr + H2SO4 Br2 + Cr2(SO4)3 + K2SO4 + H2O
Thực hiện các yêu cầu sau đây:
- a) Xác định số oxi hóa của các nguyên tố crom (Cr) và nguyên tố brom (Br).
- b) Xác định chất oxi hóa, chất khử.
- c) Biểu diễn quá trình oxit hóa, quá trình khử.
- d) Cân bằng phương trình phản ứng hóa học trên theo phương pháp thăng bằng electron.
Câu 7: (2 điểm) Nguyên tố R là một trong những nguyên tố phổ biến nhất trong vỏ Trái Đất. Nguyên tố R thuộc nhóm IVA, trong hợp chất khí với hiđro của R có tỉ lệ khối lượng giữa hiđro và R là mH : mR = 1 : 7.
- a) Hãy xác định nguyên tố R.
- b) Oxit cao nhất của R phổ biến trong tự nhiên ở dạng cát hay thạch anh, cũng như trong cấu tạo thành tế bào của tảo cát và một số thảo trùng. Oxit cao nhất của R cũng là thành phần chủ yếu của một số thủy tinh và chất chính trong bê tông. Hãy tính thành phần phần trăm về khối lượng của R có trong oxit cao nhất.
Câu 8: (1 điểm) Hòa tan hoàn toàn 0,324 gam kim loại M vào dung dịch HCl thì thu được 0,3024 lít khí hiđro (đktc). Hãy xác định kim loại M.
ĐỀ THI HỌC KỲ 1 HÓA HỌC 10, TRƯỜNG THPT GIA ĐỊNH, QUẬN BÌNH THẠNH, TPHCM, NĂM 2017-2018
Câu 1: Thực hiện chuỗi phản ứng sau (ghi rõ điều kiện phản ứng nếu có):
- a) Al H2 HCl Cl2 NaCl NaOH
- b) FeCl2 FeCl3 Fe(OH)3
Câu 2: Cân bằng phản ứng sau theo phương pháp thăng bằng e. Xác định chất oxi hóa, chất khử, sự khử, sự oxi hóa:
- a) Zn + HNO3 Zn(NO3)2 + NO + H2O
- b) NaCrO2 + Cl2 + NaOH Na2CrO4 + NaCl + H2O
Câu 3:
- a) Viết công thức cấu tạo của các phân tử sau: Br2, NH3, SiO2, H2SO4.
- b) Dựa vào độ âm điện, hãy cho biết kiểu liên kết trong phân tử các chất sau thuộc loại liên kết ion, liên kết cộng hóa trị có cực hay liên kết cộng hóa trị không cực: BaO, C2H4, NaCl, O2.
Câu 4: Cho 18,6 (g) hỗn hợp A gồm Fe và Zn ta hòa tan trong 100 ml dung dịch HCl 0,75M (lấy dư) thấy có 6,72 (l) khí (đktc) bay ra và dung dịch B.
- a) Tính % khối lượng mỗi kim loại.
- b) Tính nồng độ mol các chất trong dung dịch B, xem thể tích dung dịch không thay đổi sau mỗi phản ứng.
Câu 5: Cho hỗn hợp Y gồm 2 khí CO2 và NO2 có tỉ khối so với khí Oxi là 1,4. Tính % theo thể tích và % theo khối lượng của CO2 trong hỗn hợp Y.
Câu 6: Cho 3 (g) một oxit của một kim loại nhóm IA vào nước dư, thu được dung dịch X. Cho X tác dụng với 90 ml dung dịch H2SO4 1M, thấy dung dịch sau phản ứng làm quỳ tím hóa xanh. Xác định công thức oxit kim loại đã dùng.
ĐỀ THI HỌC KỲ 1 HÓA HỌC 10, TRƯỜNG THPT HÀN THUYÊN, QUẬN PHÚ NHUẬN, TPHCM, NĂM 2017-2018
Câu 1: (1 điểm) Xác định số proton, electron, nơtron và số khối của: Al3+; Br; P3-; NH4+.
Câu 2: (1 điểm) Viết công thức cấu tạo của các chất sau: H2CO3, N2, SiO2, C2H6O.
Câu 3: (1 điểm) Cho cấu hình electron lớp ngoài cùng của 2 ion sau: X2-: 3s23p6 và Y3+: 2s22p6.
- a) Viết phương trình tạo thành 2 ion trên. b) Viết cấu hình electron của nguyên tử X và Y.
Câu 4: (1 điểm) So sánh tính kim loại của các nguyên tố sau: .
Câu 5: (2 điểm) Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron. Xác định chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa:
- a) P + H2SO4 H3PO4 + SO2 + H2O b) Zn + HNO3 Zn(NO3)2 + NH4NO3 + H2O
Câu 6: (2 điểm) Một nguyên tử của nguyên tố R có phân mức năng lượng ngoài cùng là ns2np3. Trong oxit cao nhất của nó chứa 43,662% R về khối lượng.
- a) Xác định tên R.
- b) Cho oxit cao nhất của R vào H2O, sau đó lấy sản phẩm tác dụng với NaOH dư. Viết các phương trình phản ứng xảy ra.
Câu 7: (2 điểm) Cho 16,45 gam một oxit kim loại X thuộc nhóm IA tan hết trong 200 ml dung dịch HCl 1,75M.
- a) Tìm tên kim loại X.
- b) Nếu hòa tan hết lượng oxit kim loại trên vào nước thì thu được dung dịch A. Tính thể tích dung dịch H2SO4 0,2M cần để trung hòa hết dung dịch A.
ĐỀ THI HỌC KỲ 1 HÓA HỌC 10, TRƯỜNG THPT LÊ QUÝ ĐÔN, ĐỀ A, QUẬN 1, TPHCM, NĂM 2017-2018
Câu 1: (2 điểm) Viết công thức cấu tạo khai triển của các phân tử: H2S, Cl2O3, P2O5 và C6H6 (benzen)
Câu 2: (1,5 điểm) Viết phương trình tạo ion từ nguyên tử, phương trình hình thành liên kết ion và phương trình hóa học (có vẽ sự di chuyển electron) để giải thích sự hình thành liên kết ion trong phân tử K2S.
Câu 3: (0,5 điểm) Trong số các phản ứng (a), (b), (c), (d) dưới đây, phản ứng nào thuộc loại phản ứng oxi hóa – khử ? (không cần giải thích).
Ÿ Giấm ăn (dung dịch CH3COOH) là gia vị quen thuộc. Một trong những phản ứng sinh hóa xảy ra trong quá trình sản xuất giấm là lên men ancol etylic:
CH3CH2OH + O2 CH3COOH + H2O (a)
Ÿ Để nhận biết sự có mặt của khí độc H2S, ta có thể dùng miếng giấy lọc tẩm dung dịch muối chì axetat (không màu), phản ứng xảy ra tạo chất kết tủa màu đen:
H2S + (CH3COO2)Pb PbS (đen) + 2CH3COOH (b)
Ÿ Nước Javel có chứa NaClO (muối có tính oxi rất mạnh), được sử dụng làm chất tẩy trắng, sát trùng. Trong phòng thí nghiệm, nước Javel được điều chế bằng phản ứng:
Cl2 + 2NaOH NaCl + NaClO + H2O (c)
Ÿ “Thuốc chuột” có thành phần chính là Zn3P2. Thuốc làm chuột chết do sau khi ăn, Zn3P2 bị thủy phân mạnh tạo khí photphin (PH3) rất độc:
Zn3P2 + 6H2O 3Zn(OH)2 + 2PH3 (d)
Câu 4: (3 điểm) Cân bằng phương trình hóa học của các phản ứng oxi hóa – khử sau theo phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa ở mỗi phản ứng:
- a) SO2 + KMnO4 + H2O K2SO4 + MnSO4 + H2SO4
- b) As2S3 + HNO3 + H2O H3AsO4 + NO + H2SO4
Câu 5: (2 điểm) Cho 2,4 gam một kim loại X (có hóa trị II) tác dụng hoàn toàn với 100 gam dung dịch HCl 14,6% thu được dung dịch B và 2,24 lít khí hidro (đktc).
- a) Xác định tên kim loại X.
- b) Các chất trong dung dịch B tác dụng vừa đủ với V lít dung dịch NaOH 0,5M. Viết phương trình phản ứng xảy ra và tính giá trị của V.
Câu 6: (1 điểm) Cân bằng phản ứng oxi hóa – khử sau theo phương pháp thăng bằng electron:
MxOy + HNO3 Mn(NO3)n + NO + H2O
ĐỀ THI HỌC KỲ 1 HÓA HỌC 10, TRƯỜNG THPT BÙI THỊ XUÂN, QUẬN 1, TPHCM, NĂM 2017-2018
Câu 1: (4 điểm)
- a) Viết cấu hình electron và xác định vị trí của Cl (Z = 17) trong bảng tuần hoàn.
- b) Viết phương trình hóa học xảy ra khi cho khí clo lần lượt tác dụng với H2O, Na. Trong các sản phẩm tạo thành, viết công thức cấu tạo chất có chứa liên kết cộng hóa trị và giải thích sự tạo thành hợp chất có liên kết ion.
- c) Cho sơ đồ điều chế clo trong phòng thí nghiệm.
Hãy cho biết chất A, B và viết phương trình hóa học các phản ứng xảy ra trong quá trình điều chế trên.
Câu 2: (2 điểm)
- a) Hòa tan hoàn toàn 4,6 gam kim loại kiềm R vào nước, sau phản ứng thu được 2,24 lít khí (đktc). Xác định khối lượng mol nguyên tử R.
- b) Cho m gam nhôm tác dụng vừa đủ với 6,72 lít khí clo (đktc), sau phản ứng thu được muối X. Tính m và nồng độ % của dung dịch thu được khi hòa tan toàn bộ muối X trên vào 100 gam H2
Câu 3: (2 điểm) Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron:
- a) Cu + HNO3 Cu(NO3)2 + NO + H2O b) Fe3O4 + H2SO4(đặc) Fe2(SO4)3 + SO2 + H2O
Câu 4: (2 điểm)
- a) Một ion M2+ có tổng số hạt proton, nơtron, electron là 58, trong đó số hạt mang điện tích âm bằng 45% số khối. Tìm số hiệu nguyên tử của M.
- b) Hòa tan hoàn toàn 12,6 gam hỗn hợp Y gồm Mg và kim loại X (tỉ lệ mol tương ứng là 3:2) bằng dung dịch H2SO4 đặc nóng dư thu được 1,344 lít H2S (đktc); 3,84 gam S (không có sản phẩm khử nào khác). Xác định khối lượng mol nguyên tử của X.
ĐỀ THI HỌC KỲ 1 HÓA HỌC 10, TRƯỜNG THPT LƯƠNG THẾ VINH, QUẬN 1, TPHCM, NĂM 2017-2018
Câu 1: (1 điểm) Xác định số oxi hóa của các nguyên tố trong các phân tử và ion sau: N2, Al3+, Fe2O3,
Câu 2: (2 điểm) Hãy giải thích sự hình thành liên kết giữa:
- a) Magie.
- b) Natri và lưu huỳnh.
Câu 3: (2,5 điểm) Một nguyên tố tạo hợp chất khí với hiđro có công thức RH4.
- a) R là nguyên tố nào.
- b) Viết cấu hình electron của nguyên tố R, xác định vị trí (ô, chu kì, nhóm) của nguyên tố R trong bảng hệ thống tuần hoàn.
- c) Viết công thức cấu tạo hợp chất khí của nguyên tố R với hiđro.
Câu 4: (1 điểm) Tìm số proton, electron, nơtron của nguyên tử và ion sau đây:
- a)
- b)
Câu 5: (1,5 điểm) Hòa tan hoàn toàn 1,7 gam hỗn hợp hai kim loại A, B đều thuộc nhóm IA và ở hai chu kì liên tiếp nhau trong bảng tuần hoàn vào nước thu được 0,672 lít khí H2 (đktc) và dung dịch X.
- a) Xác định tên hai kim loại đó.
- b) Tính nồng độ mol từng chất tan trong dung dịch X, biết đã dùng 500 ml nước cho phản ứng. Giả thiết thể tích sau phản ứng thay đổi không đáng kể.
Câu 6: (2 điểm) Cân bằng các phản ứng oxi hóa khử sau bằng phương pháp cân bằng electron. Xác định chất khử, chất oxi hóa, quá trình khử và quá trình oxi hóa.
- a) C + HNO3(đặc) CO2 + NO2 + H2O
- b) FeS + HNO3 Fe(NO3)3 + NO + H2S + H2O
ĐỀ THI HỌC KỲ 1 HÓA HỌC 10, TRƯỜNG THPT NGUYỄN THỊ MINH KHAI, QUẬN 3, TPHCM, NĂM 2017-2018
Câu 1: Cho 3 nguyên tố X, Y, T.
X có mức năng lượng cao nhất là: 4s1.
Y2+ có cấu hình e lớp ngoài cùng là: 2s22p6.
T có số hiệu nguyên tử là 20.
- a) Viết cấu hình e đầy đủ X, Y, T. Xác định vị trí X, Y, T trong bảng tuần hoàn hóa học?
- b) Xếp theo thứ tự kim loại tăng dần X, Y, T?
Câu 2: Hợp chất khí với hiđro có dạng RH3. Trong hợp chất oxit cao nhất của R, oxi chiếm 56,338% theo khối lượng. Xác định tên nguyên tố R? Tìm % khối lượng R trong hợp chất hiđroxit tương ứng với oxit cao nhất?
Câu 3: Mô tả sự hình thành liên kết ion trong phân tử CaCl2?
Câu 4: Viết công thức e, công thức cấu tạo: CO2, H2SO4?
Câu 5: Cân bằng các phản ứng sau theo phương pháp thăng bằng e, xác định chất khử, chất oxi hóa:
- a) Cu + HNO3 Cu(NO3)2 + NO + H2O
- b) KI + KMnO4 + H2SO4 K2SO4 + MnSO4 + I2 + H2
Câu 6: Đốt cháy hoàn toàn 10,8 (g) kim loại X hóa trị III bằng lượng vừa đủ 6,72 (l) khí oxi (đktc) thu được oxit M tương ứng.
- a) Xác định tên kim loại X?
- b) Cho lượng oxit M thu được trên tan hoàn toàn vào dung dịch H2SO4 25% thu được dung dịch Y. Để trung hòa dung dịch Y cần dùng 100 ml dung dịch NaOH 1M. Tính nồng độ % các chất tan trong dung dịch Y?
ĐỀ THI HỌC KỲ 1 HÓA HỌC 10, TRƯỜNG THPT LÊ QUÝ ĐÔN, ĐỀ B, QUẬN 1, TPHCM, NĂM 2017-2018
Câu 1: (2 điểm) Viết công thức cấu tạo khai triển của các phân tử: H2S, P2O3, HNO3 và C3H8.
Câu 2: (1,5 điểm) Viết phương trình tạo ion từ nguyên tử, phương trình hình thành liên kết ion và phương trình hóa học (có vẽ sự di chuyển electron) để giải thích sự hình thành liên kết ion trong phân tử K2O.
Câu 3: (3 điểm) Trong số các phản ứng (a), (b), (c), (d) dưới đây, phản ứng nào thuộc loại phản ứng oxi hóa – khử ? (không cần giải thích).
Ÿ Giấm ăn (dung dịch CH3COOH) là gia vị quen thuộc. Một trong những phản ứng sinh hóa xảy ra trong quá trình sản xuất giấm là lên men ancol etylic:
CH3CH2OH + O2 CH3COOH + H2O (a)
Ÿ Để nhận biết sự có mặt của khí độc H2S, ta có thể dùng miếng giấy lọc tẩm dung dịch muối chì axetat (không màu), phản ứng xảy ra tạo chất kết tủa màu đen:
H2S + (CH3COO)2Pb PbS (đen) + 2CH3COOH (b)
Ÿ Nước Javel có chứa NaClO (muối có tính oxi rất mạnh), được sử dụng làm chất tẩy trắng, sát trùng. Trong phòng thí nghiệm, nước Javel được điều chế bằng phản ứng:
Cl2 + 2NaOH NaCl + NaClO + H2O (c)
Ÿ “Thuốc chuột” có thành phần chính là Zn3P2. Thuốc làm chuột chết do sau khi ăn, Zn3P2 bị thủy phân mạnh tạo khí photphin (PH3) rất độc:
Zn3P2 + 6H2O 3Zn(OH)2 + 2PH3 (d)
Câu 4: (3 điểm) Cân bằng phương trình hóa học của các phản ứng oxi hóa – khử sau theo phương pháp thăng bằng electron và cho biết chất khử, chất oxi hóa ở mỗi phản ứng:
- a) P + HNO3 H3PO4 + NO2 + H2O
- b) K2Cr2O7 + HCl KCl + CrCl3 + Cl2 + H2O
Câu 5: (2 điểm) Cho 1,56 gam kim loại R (ở nhóm IA) vào 200 gam nước, sau phản ứng xảy ra hoàn toàn thu được 0,448 lít khí hidro (đktc) và dung dịch B.
- a) Xác định tên kim loại R.
- b) Để trung hòa dung dịch B cần dùng vừa đủ m gam dung dịch HCl 20%. Tìm giá trị của m.
Câu 6: (1 điểm) Anion có tổng số hạt proton, nơtron, electron là 53; trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 17. Xác định tên nguyên tố R.

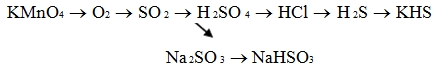

 Trang Trước
Trang Trước




