CÁCH PHA CHẾ DUNG DỊCH CHUẨN
Phần 2: Thực hành
CÁCH PHA CHẾ DUNG DỊCH CHUẨN
I. Chất gốc
Để điều chế các dung dịch chuẩn có nồng độ biết chính xác, người ta phải dùng các chất gốc. Chất gốc là chất phải thoả mãn những điều kiện sau:
- Thường là những chất rắn nguyên chất, có độ tinh khiết cao (lượng tạp chất không vượt quá 0,01 – 0,02%)
- Có thành phần ứng với một công thức hoá học xác định kể cả lượng nước kết tinh.
- Bền cả dạng rắn và dạng dung dịch trong suốt quá trình điều chế và bảo quản.
Một số chất gốc thường gặp như borax Na2B4O7.10H2O, axit oxalic H2C2O4.2H2O, axit benzoic C6H5COOH, AgNO3, K2Cr2O7,. . .
II. Pha chế dung dịch chuẩn.
1. Pha chế dung dịch chuẩn từ chất gốc.
Nếu thuốc thử là chất gốc thì việcđiều chế dung dịch chuẩn gồm các bước sau:
- Tính toán lượng chất gốc cần thiết cho quá trình điều chế dung dịch chuẩn.
- Dùng cân phân tích có độ chính xác 0,1 mg cân chình xác lượng chất gốc đã tính.
- Hoà tan và chuyển vào bình định mức có thể tích bằng thể tích dung dịch chuẩn cần điều chế, rồi thêm dung môi tới vạch.
Ví dụ: Điều chế 500mL dung dịch chuẩn H2C2O4 0,1M ta phải làm các bước như sau:
- Tính lượng H2C2O4.2H2O cần thiết trong quá trình điều chế:
- Dùng cân phân tích cân chính xác 6,3 gam chất rắn H2C2O4.2H2O
- Hoà tan lượng H2C2O4.2H2O vừa cân được vào nước, chuyển vào bình định mức 500 mL rồi thêm nước cho tới vạch.
2. Pha chế dung dịch chuẩn từ chất không phải là chất gốc.
Quá trình điều chế gồm 2 giai đoạn như sau:
- Giai đoạn 1: Điều chế dung dịch có nồng độ gần đúng, cách làm tương tự như điều chế dung dịch chuẩn từ chất gốc.
- Giai đoạn 2: Xác định chính xác nồng độ dung dịch được điều chế ở trên, bằng cách chuẩn độ với dung dịch chuẩn gốc thích hợp.
Ví dụ: Điều chế 1 lít dung dịch chuẩn NaOH, ta làm như sau:
- Giai đoạn 1: điều chế dung dịch NaOH có nồng độ gần đúng 0,1M.
+ Tính lượng NaOH cần thiết trong quá trình điều chế:
mNaOH = 1 . 0,1 . 40 = 4 (gam)
+ Dùng cân phân tích cân chính xác 4 gam chất rắn NaOH.
+ Hoà tan lượng NaOH vừa cân được vào nước, chuyển vào bình định mức 1 lít rồi thêm nước cho tới vạch.
- Giai đoạn 2: xác định chính xác nồng độ dung dịch NaOH vừa pha chế ở trên bằng cách chuẩn độ với dung dịch chuẩn gốc là dung dịch H2C2O4 0,1M.
3. Pha chế dung dịch chuẩn từ ống chuẩn.
" Ống chuẩn" là ống trong đó đã chứa sẵn một lượng chính xác thuốc thử ở dạng rắn hoặc lỏng. Khi dùng ống chuẩn để pha chế dung dịch người ta chuyển toàn bộ thuốc thử trong ống chuẩn vào bình định mức 1 lít rồi thêm nước cho tới vạch ta được 1 lít dung dịch chuẩn có nồng độ ghi trên nhãn của ống chuẩn.
Ví dụ: Trên nhãn ống chuẩn ghi HCl 1M, nghĩa là chuyển toàn bộ lượng HCl trong ống chuẩn vào bình định mức 1 lít rồi thêm nước cho tới vạch ta được 1 lít dung dịch chuẩn HCl 1M.
4. Pha chế dung dịch chuẩn từ dung dịch có nồng độ lớn hơn.
Cách tiến hành như sau:
- Tính toán lượng dung dịch có nồng độ cao cần thiết cho quá trình điều chế.
- Dùng dụng cụ đo lường thể tích lấy chính xác lượng dung dịch có nồng độ cao vừa tính được.
- Cho lượng thể tích trên vào bình định mức có thể tích bằng thể tích dung dịch chuẩn cần điều chế rồi thêm dung môi cho tới vạch.
Ví dụ: Điều chế 1 lít dung dịch HCl 0,1M từ dung dịch HCl 1M, ta tiến hành như sau:
- Tính lượng dung dịch HCl 1M cần cho quá trình điều chế:
- Dùng dụng cụ đo lường thể tích lấy chính xác 100 mL dung dịch HCl 1M.
- Cho 100 mL dung dịch HCl 1M vào bình định mức 1 lít rồi thêm nước cho tới vạch ta được 1 lít dung dịch HCl 0,1M.
CHUẨN ĐỘ AXIT MẠNH BẰNG BAZƠ MẠNH VÀ NGƯỢC LẠI
I. Dụng cụ - hoá chất:
1. Dụng cụ: - Burette
- Pipette
- 3 bình erlen 250mL
- 3 cốc thuỷ tinh 250mL
- Dung dịch NaOH có nồng độ chính xác 0,1M
- Dung dịch HCl có nồng độ chính xác 0,1M
- Dung dịch NaOH chưa biết nồng độ
- Dung dịch HCl chưa biết nồng độ
- Chất chỉ thị: metyl dacam (Heliantin); P.P
II. Nguyên tắc:
Dựa vào phản ứng chuẩn độ: H+ + OH-  H2O
H2O
Kết thúc chuẩn độ khi chất chỉ thị đổi màu.
III. Cách tiến hành:
1. Chuẩn độ axit mạnh bằng bazơ mạnh:
Dùng pipette lấy chính xác 20mL dung dịch HCl (chưa biết nồng độ) cho vào bình erlen, thêm 3 giọt chất chỉ thị, chuẩn độ bằng dung dịch NaOH 0,1M từ trên burettte xuống, lắc đều, cho đến khi dung dịch đổi màu.
Lần lượt dùng các chất chỉ thị khác nhau như: metyl da cam,
Phenolphtalein (PP)
 Quan sát sự thay đổi màu sắc trong mỗi trường hợp chuẩn độ.
Quan sát sự thay đổi màu sắc trong mỗi trường hợp chuẩn độ.
Ghi thể tích dung dịch NaOH tiêu tốn.
Làm lạI thí nghiệm 3 lần lấy kết quả trung bình:
VTB =
Tính nồng độ dung dịch HCl.
Nhận xét.
2. Chuẩn độ bazơ mạnh bằng axit mạnh:
Dùng pipette lấy chính xác 20mL dung dịch NaOH (chưa biết nồng độ) cho vào bình erlen, thêm 3 giọt chất chỉ thị, chuẩn độ bằng dung dịch HCl 0,1M từ trên burettte xuống, lắc đều, cho đến khi dung dịch đổi màu.
Lần lượt dùng các chất chỉ thị khác nhau như: metyl da cam,
Phenolphtalein (PP)
Quan sát sự thay đổi màu sắc trong mỗi trường hợp chuẩn độ.
Ghi thể tích dung dịch HCl tiêu tốn.
Làm lạI thí nghiệm 3 lần lấy kết quả trung bình.
Tính nồng độ dung dịch NaOH.
CHUẨN ĐỘ AXIT YẾU BẰNG BAZƠ MẠNH VÀ
CHUẨN ĐỘ BAZƠ YẾU BẰNG AXIT MẠNH
I. Dụng cụ - hoá chất:
1. Dụng cụ:
- Burette
- Pipette
- 3 bình erlen 250mL
- 3 cốc thuỷ tinh 250mL
2. Hoá chất:
- Dung dịch NaOH có nồng độ chính xác 0,1M
- Dung dịch HCl có nồng độ chính xác 0,1M
- Dung dịch CH3COOH chưa biết nồng độ
- Dung dịch NH3 chưa biết nồng độ
- Chất chỉ thị: metyl dacam (Heliantin); P.P
II. Cách tiến hành:
Dùng pipette lấy chính xác 20mL dung dịch CH3COOH (chưa biết nồng độ) cho vào bình erlen, thêm 3 giọt chất chỉ
thị, chuẩn độ bằng dung dịch NaOH 0,1M từ trên burettte xuống, lắc đều, cho đến khi dung dịch đổi màu.
Lần lượt dùng các chất chỉ thị khác nhau như: metyl da cam,
Phenolphtalein (PP)
Quan sát sự thay đổi màu sắc trong mỗi trường hợp chuẩn độ.
Ghi thể tích dung dịch NaOH tiêu tốn.
Làm lạI thí nghiệm 3 lần lấy kết quả trung bình.
Tính nồng độ dung dịch CH3COOH.
Nhận xét.
2. Chuẩn độ bazơ yếu bằng axit mạnh:
Dùng pipette lấy chính xác 20mL dung dịch NH3 (chưa biết
nồng độ) cho vào bình erlen, thêm 3 giọt chất chỉ thị,
chuẩn độ bằng dung dịch HCl 0,1M từ trên burettte
xuống, lắc đều, cho đến khi dung dịch đổi màu.
Lần lượt dùng các chất chỉ thị khác nhau như: metyl da cam,
Phenolphtalein (PP)
Quan sát sự thay đổi màu sắc trong mỗi trường hợp chuẩn độ.
Ghi thể tích dung dịch HCl tiêu tốn. Làm lại thí nghiệm 3 lần lấy kết quả trung bình. Tính nồng độ dung dịch NH3. Nhận xét.
Phần 3: Một số bài tập tham khảo
Hãy vẽ đường cong chuẩn độ bằng cách tình vài điểm đặc trưng và chọn chất chỉ thị cho phép chuẩn độ 50,00 mL dung dịch CH3COOH 0,1000 M ; Ka = 10-4,75 với dung dịch NaOH 0,1000 M. Có thể tham khảo bảng sau.
Một số chất chỉ thị axit – bazơ
| Tên chất chỉ thị | Khoảng đổi màu pH | Độ chuyển màu |
| Metyl da cam | 3,2 – 4,4 | Đỏ - Da cam |
| Metyl đỏ | 4,2 – 6,2 | Đỏ - Vàng |
| Brom thymol xanh | 6,0 - 7,6 | Vàng – Xanh |
| Phenol đỏ | 6,8 – 8,2 | Vàng – Đỏ |
| Phenolphtalein | 8,0 – 9,8 | Không màu – Đỏ |
| Thymolphtalein | 9,3 – 10,3 | Không màu - Xanh |
Hướng dẫn:
Phản ứng chuẩn độ: CH3COOH + OH- 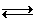 CH3COO- + H2O
CH3COO- + H2O
- Trước khi chuẩn độ: dung dịch là dung dịch axit yếu CH3COOH nên pH của dung dịch được tính theo công thức sau:
pH = ½ (4,75 – lg 0,1000) = 2,88
- pH sau khi thêm 10 mL dung dịch NaOH: dung dịch gồm CH3COOH dư và CH3COONa nên dung dịch là hệ đệm pH.
- pH sau khi thêm 49,95 mL dung dịch NaOH: dung dịch gồm CH3COOH dư và CH3COONa nên dung dịch là hệ đệm pH.
- pH sau khi thêm 50,00 mL dung dịch NaOH: dung dịch là dung dịch CH3COONa. pH của dung dịch được xác định theo công thức tính pH của dung dịch bazơ yếu CH3COO- có hằng số bazơ Kb =  = 10-9,25
= 10-9,25
pH = 14 - ½ (9,25 – lg(0,0500)) = 8,72
- pH sau khi thêm 50,05 mL dung dịch NaOH: dung dịch gồm NaOH dư và CH3COONa nên pH của dung dịch có thể tính gần đúng theo công thức tính pH của dung dịch bazơ mạnh
pH = 14 + lg (4,9975.10-5) = 9,7
Từ các điểm pH trên ta vẽ được đường chuẩn độ.
Điểm tương đương có giá trị pH là 8,72 nên dựa trên khoàng đổi màu của các chất chỉ thị trên ta có thể sử dụng phenolphtalein thì kết quả chính xác nhất.
Chuẩn độ 25,00 mL dung dịch axit yếu đơn chức HX cần 18,22 mL dung dịch NaOH 0,0640 M. Sự biến đổi pH của dung dịch theo phần trăm HX chuẩn độ được nêu trong bảng sau:
| %HX chuẩn độ | 0 | 33,3% | 66,7% |
| pH | 3,39 | 5,14 | 5,74 |
a. Tính nồng độ ban đầu của axit yếu HX.
b. Xác định trị số Ka của axit ứng với mỗi giai đoạn chuẩn độ nêu trong bảng số liệu trên.
c. Tính pH tại điểm tương đương trong quá trình chuẩn độ trên.
Hướng dẫn:
b.
| %HX chuẩn độ | 0%HX | 33,3%HX | 66,7%HX |
| pH | 3,39 | 5,14 | 5,74 |
| [H+] | 4,07 . 10-4 | 7,24 . 10-6 | 1,82 . 10-6 |
| = 3,56 . 10-6 | = 3,62 . 10-6 | = 3,64 . 10-6 |
c. Tại điểm tương đương dung dịch là dung dịch bazơ yếu CH3COO-
X- + H2O  HX + OH- Kb =
HX + OH- Kb =  = 2,78. 10-9
= 2,78. 10-9
[X-] =  = 0,027(M) ; pKb = - lgKb = 8,56
= 0,027(M) ; pKb = - lgKb = 8,56
pH = 14 - ½ (8,56– lg(0,027)) = 8,94


















 Trang Trước
Trang Trước





:'(
ReplyDelete:'(
ReplyDeleteai chi minh cach pha AgNO3 0,05N voi
ReplyDeleteai chi minh cach pha AgNO3 0,05N voi
ReplyDeletePha từ chất có nồng độ ntn b?
Deletenếu từ ống chuẩn 0.1N thì hút 50 ml AgNO3 0.1N và thêm 50 ml nước cất là dc. còn nếu pha từ AgNO3 khan thì phải pha 1 lít nha bạn, do 0.05 ít quá, sợ cân ko chuẩn.
Deletenếu pha dd AgNO3 0,02M từ ống chuẩn 0,1N thì pha thế nào b
DeleteLabVIETCHEM tuy là một thương hiệu mới trên thị trường cung cấp hóa chất thí nghiệm nhưng đã phần nào khẳng định được chỗ đứng của mình. Với phương châm mang đến cho khách hàng những sản phẩm chất lượng với mức giá cạnh tranh nhất. Hóa chất thí nghiệm labvietchem xứng đáng là địa chỉ mà các bạn đang tìm kiếm.
ReplyDeleteDanh mục hóa chất thí nghiệm mà LabVIETCHEM nhập khẩu và phân phối tại Việt Nam.
- Hóa chất thí nghiệm hãng Merck – Đức
- Hóa chất Prolabo – Pháp
- Hóa chất Hach
- Hóa chất Samchun – Hàn Quốc
- Hóa chất thí nghiệm Trung Quốc
Bên cạnh đó là các dụng cụ phòng thí nghiệm:
- Dụng cụ thí nghiệm thủy tinh hãng Duran Đức
- Hãng Kartell - Ý
- Whatman – Anh
- Boeco – Đức
- Assistant – Đức
.....
Tại sao bạn nên mua hóa chất thí nghiệm labvietchem?
- Danh mục sản phẩm vô cùng đa dạng, chất lượng đã được kiểm chứng và đáp ứng được cho mọi đối tượng khách hàng
- Dịch vụ giao hàng chuyên nghiệp, nhanh chóng
- Giá cạnh tranh nhất trên thị trường
- Hỗ trợ trực tuyết 24/7
- Website thương mại điện tử mua sắm dễ dàng
Nhấc máy và gọi đến số hotline 1900 2639 để được báo giá chi tiết về hóa chất thí nghiệm labvietchem.