Hidrocacbon 3
Bài 1. Xicloankan nào có đồng phân cis – trans ? Nếu có vẽ cả hai đồng phân đó.
(a) 1,3-dimetylxiclopantan
(b) Etylxiclopantan
(c) 1-etyl-2-metylxiclobutan
@ Bài giải
(a) 1,3-dimetylxiclopantan. Có đồng phân cis – trans


(b) Etylxiclopantan. Không có đồng phân cis-trans.

Hai chất trên là một.
(c) 1-etyl-2-metylxiclobutan: Có đồng phân cis-trans
Bài 2. Hai hợp chất hữu cơ A và B đều có công thức phân tử C5H10. Cả hai đều không phản ứng với Cl2 trong tối và lạnh. A phản ứng với Cl2 có ánh sáng, nhưng cho một sản phẩm duy nhất là C5H9Cl. Còn hợp chất B cũng tác dụng với Cl2 trong cùng điều kiện nhưng cho 6 đồng phân C5H9Cl khác nhau, có thể phân biệt bằng phương pháp vật lý. Hãy xác định cấu trúc của A, B và các sản phẩm monoclo đó.
@ Bài giải:
A và B có công thức C5H10 nên chúng có thể là anken hoặc xicloankan. Theo đều bài, các chất này không tác dụng với Cl2 tối và lạnh nên A và B là các xicloankan.
A tác dụng với Cl2 cho một monoclo duy nhất nên A là xiclopentan
B tác dụng với Cl2 (ánh sáng) tao ra 6 dẫn xuất monoclo, nên B phải là metylxiclobutan.
Bài 3. Sức căng Baeyer là gì?
@ Bài giải
Xuất phát từ hai tiên đề là các vòng no có cấu trúc phẳng và góc bình thường của hiđrocacbon no là 109028', năm 1885, Baeyer cho rằng sự éo nhỏ hay trương rộng các góc của vòng no đều dẫn đến một sức căng là cho tính bền của vòng giảm đi. Người ta gọi đó là sức căng Baeyer. Sức căng càng lớn, vòng tương ứng càng ít bền. Độ mạnh của sức căng được đánh giá bằng q. q được tính theo công thức
ví dụ:
| n | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| q | 24044' | 9044' | 0044' | -5044' | 9033' | 12046' | -15006' |
Bài 4. Vì sao nói liên kết C-C trong xilopropan được gọi là "liên kết quả chuối" ?
@ Bài giải
Xiclopropan là hợp chất vòng no duy nhất có cấu tạo phẳng. Theo quan niệm hiện đại, phần xen phủ cực đại của các đám mây electron không nằm trên đường thẳng nối liên hai nguyên tử cacbon mà có sự uốn cong. Sự uốn cong này làm cho phần xen phủ đám mây electron có giảm đi, nhưng sắp xếp như thế có lợi về mặt năng lượng. Các liên kết C-C này được gọi là "liên kết quả chuối", nó mang tính chất trung gian giữa liên kết s và p bình thường. Do sự uốn cong như vậy, thực tế góc liên kết của vòng chỉ bằng 1060 chứ không phải 109028' và lớn hơn nhiều so với góc cấu tạo phẳng của tam giác đều (600). Xiclopropan rất dễ bị mở vòng dưới tác dụng của hiđrohalogenua, Br2 và bị hiđro hoá có chất xúc tác.

Bài 5. Thế nào là lực đẩy Pitze?
@ Bài giải
Thực tế, các vòng no (trừ xiclopropan) không phải là những vòng phẳng. Trong một vòng ngoài sức căng góc Baeyer có có một lực đẩy nữa đó là lực đẩy giữa các nguyên tử hiđro ở trạng thái che khuất một phần hay toàn phần gây nên, đo đó một vài nguyên cacbon của vòng bị lệch ra khỏi mặt phẳng vòng. Lực đẩy đó gọi là lực đẩy Pitze
Bài 6. Nguyên nhân nào để xiclobutan tồn tại ở dạng không phẳng?
@ Bài giải
Theo quan niệm hiện nay, xiclobutan có cấu tạo không phẳng góc gấp có giá trị khoảng 20-250. Tính không phẳng của xiclobutan được chứng tỏ từ các dữ kiện thực nghiệm của giản đồ Rơnghen, giản đồ electron, momen lưỡng cực, phổ cộng hưởng từ hạt nhân và một số phương pháp khác. Nguyên nhân chủ yếu để xiclobutan tồn tại dạng không phẳng là để giảm sức căng Pitz.
Bài 7. Xiclopentan tồn tại hai cấu dạng không phẳng: dạng "phong bì" và dạng "nửa ghế". Hãy vẽ hai cấu dạng này và cho biết dạng nào có tâm đối xứng, dạng nào có trục đối xứng.
@ Bài giải
C2 C5
 Nếu giả sử phân tử xiclopentan nằm trên một mặt phẳng thì góc lệch 0044, do đó coi như không có sức căng Baeyer. Nhưng ở đây 5 liên kết C-C ở dạng che khuất nên lại xuất hiện sức căng Pitz. Thực tế xiclopentan tồn tại hai cấu dạng không phẳng là cấu dạng phong bì có mặt phẳng đối xứng nên còn gọi là cấu dạng Cs. Cấu dạng nửa ghế có trục đối xứng bậc hai nên còn gọi là cấu dạng C2.
Nếu giả sử phân tử xiclopentan nằm trên một mặt phẳng thì góc lệch 0044, do đó coi như không có sức căng Baeyer. Nhưng ở đây 5 liên kết C-C ở dạng che khuất nên lại xuất hiện sức căng Pitz. Thực tế xiclopentan tồn tại hai cấu dạng không phẳng là cấu dạng phong bì có mặt phẳng đối xứng nên còn gọi là cấu dạng Cs. Cấu dạng nửa ghế có trục đối xứng bậc hai nên còn gọi là cấu dạng C2.
Lưu ý: Khi thực hiện phép quay phân tử xung quanh trục đối xứng Cn một góc  sao cho phân tử trùng với chính nó. Trục quay Cn gọi là trục đối xứng cấp n.
sao cho phân tử trùng với chính nó. Trục quay Cn gọi là trục đối xứng cấp n.
Bài 8. Dựa vào giản đồ thế năng sau, cho biết cấu dạng nào của xiclohexan bền nhất ? Giải thích ?

@ Bài giải
Cấu dạng ghế bền hơn cấu dạng thuyền, vì nó có thế năng thấp nhất. Nguyên nhân dẫn đến sự khác nhau về độ bền giữa hai dạng ghế và thuyền là lực đẩy tương tác giữa các nguyên tử hiđro của vòng. Ở dạng ghế tất cả đều được phân bố theo hình thể xen kẽ. Trong khi đó ở dạng thuyền chỉ có 4 hệ thống (C1-C2, C3-C4, C4-C5 và C6-C1) là phân bố xen kẻ, còn hai hệ thống còn lại C2-C3 và C5-C6) thì phân bố che khuất. Hơn nữa nguyên tử H ở C1 và C4 chỉ cách nhau 1,84  nên nó có một lực đẩy khoảng 3 kcal/mol. Tổng cộng thế năng của dạng thuyền lớn hơn dạng ghế 6,8 kcal/mol.
nên nó có một lực đẩy khoảng 3 kcal/mol. Tổng cộng thế năng của dạng thuyền lớn hơn dạng ghế 6,8 kcal/mol.
 | 
|
| Công thức Newman dạng ghế | Công thức Newman dạng thuyền |
Bài 9. Trong xiclohexan, xác đinh liên kết trục (axial) và liên kết biên (equatorial). So sánh tính bền của a-metylxiclohexan và e-metylxiclohexan. Giải thích.
@ Bài giải
Trong xiclohexan, sau nguyên tử cacbon ở dạng ghế được phân bố trên hai mặt phẳng song song. Mặt phẳng thứ nhất chứa C1, C3 và C5 ; mặt phẳng thứ hai chứa C2, C4 và C6. Trục đối xứng bậc ba của phân tử thẳng góc với hai mặt phẳng. 12 liên kết C-H được chia làm hai nhóm: nhóm thứ nhất gồm 6 nguyên tử H song song với trục đối xứng bậc ba ( 3 liên kết hướng lên và 3 liên kết hướng xuống). Ta gọi đó là liên kết trục, ký hiệu là a (axial). Nhóm thứ hai gồm 6 liên kết còn lại, chúng hướng ra ngoài biên phân tử (tạo với trục đối xứng một góc 1090 được gọi là liên kết biên, kí hiệu là e (equatorial).
Kết quả khảo sát lý thuyết cũng như thực nghiệm e-metylxiclohexan bền hơn a-metylxiclohexan. Ở nhiệt độ thường e-metylxiclohexan chiếm 95% còn a-metylxiclohexan chiếm 5%.
a-metylxiclohexan kém bền vì có đến hai tương tác syn, trong kho đó e-metylxiclohexan không có tương tác syn nào cả.
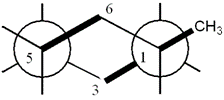 | |
| e-metylxiclohexan | a-metylxiclohexan |










 Trang Trước
Trang Trước





No comments: