Hidrocacbon 4
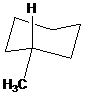
Bài 1. Xét cấu dạng sau:

(a) Nhóm metyl gắn phía dưới C-6 là liên kết trục (axial) hay liên kết biên (equatorial) ?
(b) So sánh độ bền khi nhóm metyl gắn phía dưới C-1 và C-4.
(c) Khi nhóm metyl gắn vào C3 thì tạo ra cấu dạng bền, vậy nó gắn vào dưới hay trên?
@ Bài giải
(a) Nhóm CH3 là liên kết trục (a)
(b) C-1 kém bền hơn C-4, vì liên kết trục kém bền hơn liên kết biên (e).
(c) Nhóm CH3 gắn vào C-3 tạo ra cấu dạng bền thì phải là liên kết biên, tương ứng với vị trí này là gắn vào phía dưới.
Bài 2. Xác định cấu trúc bền trong mỗi cặp cấu dạng cho dưới đây?
@ Bài giải:
Các cấu dạng bền là:
Bài 3. Đốt cháy hoàn toàn etylxiclopropan và metylxiclobutan, so sánh năng lượng giải phóng của mỗi đồng phân.
@ Bài giải
Etylxiclopropan và metylxiclobutan là đồng phân (đều có công thức phân tử C5H12). Đồng phân nào bền giải phóng năng lượng thấp. Etylxiclopropan có sức căng góc lớn và kém bền hơn metylxiclobutan.

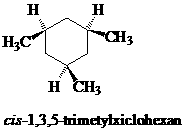
Bài 4. So sánh tính bền của đồng phân lập thể 1,3,5-trimetylxiclohexan.
@ Bài giải
Tất cả nhóm CH3 là equatorial trong cis-1,3,5-trimetylxiclohexan nên nó bền hơn trans-1,3,5-trimetylxiclohexan có chứa một nhóm CH3 là axial.


Bài 5. Viết cấu trúc phân tử có cấu dạng bền nhất cho mỗi hợp chất sau:
(a) trans-1-tert-butyl-3-metylxiclohexan
(b) cis-1-tert-butyl-3-metylxiclohexan
(c) trans-1-tert-butyl-4-metylxiclohexan
(d) cis-1-tert-butyl-4-metylxiclohexan
@ Bài giải
(a) Để có đồng phân cấu dạng bền nhất thì nhóm tert-butyl là equatorial. Sau đó thêm nhóm CH3 (axial) vào C-3 của vòng xiclohexan.
@ (b) Trước tiên vẽ xiclohexan ở dạng ghế với một nhóm tert-butyl ở vị trí equatorial. Để tạo ra cis-1-tert-butyl-3-metylxiclohexan thì phải gắn nhóm metyl vào C-3 ở vị trí equatorial.

@ (c) trans-1-tert-butyl-4-metylxiclohexan cả hai nhóm tert-butyl và C-4 metyl đều là equatorial.

@ (d) Lần nữa, nhóm tert-butyl ở vị trí equatorial, tuy nhiên, trong cis-1-tert-butyl-4-metylxiclohexan, C4-metyl phải ở vị trí axial.

Bài 6. Vẽ các đồng phân và gọi tên của hiđrocacbon có hai vòng nhưng không chứa nhóm thế ankyl có công thức phân tử C5H8.
@ Bài giải
Bài 7. Viết các đồng phân và gọi tên của hiđrocacbon có hai vòng nhưng không chứa nhóm thế ankyl có công thức phân tử C6H10
@ Bài giải
Bài 8. Hãy vẽ một mô hình phân tử cho nobonan (bixiclo[2,2,1]heptan). Vòng 6 cạnh ở dạng thuyền hay ghế? Hợp chất monoclo nobonan có bao nhiêu đồng phân khác nhau?
@ Bài giải nobonan
Vòng 6 cạnh của nobonan ở dạng thuyền.
monoclo nobonan có 4 đồng phân:
 |  |  |  |
| A | B | C | D |
A và B có thể có đồng phân quang học
Bài 9. Nhiệt đốt cháy của một số xicloankan như sau:
| Xicloankan | DH (kcal/mol) | Xicloankan | DH (kcal/mol) |
| Xiclopropan | 499,83 | Xiclonoan | 1429,50 |
| Xiclobutan | 655,86 | Xiclođecan | 1586,00 |
| Xiclopentan | 793,52 | Xiclounđecan | 1742,40 |
| Xiclohexan | 944,48 | Xiclđođecan | 1892,40 |
| Xicloheptan | 1108,20 | Xicltriđecan | 2051,40 |
| Xiclooctan | 1269,20 | Xiclotetrađecan | 2203,60 |
Hãy tính nhiệt đốt cháy của nhóm metylen trong mỗi xicloankan. Hãy tính sức căng góc trong các xicloankan trên. Biết rằng xiclohexan là tượng trưng cho hệ không có sức căng góc (sức căng góc tự do). Hãy liệt kê các loại sức căng góc trong các vòng có kích thước khác nhau.
(b) Hãy giải thích tại sao những vòng có kích thước trung bình (C7-C11) được tổng hợp với hiệu suất thấp hơn so với vòng nhỏ (C3-C6) hoặc vòng lớn (C12-Cn)?
@ Bài giải
(a) Để tính nhiệt đốt cháy của mỗi nhóm CH2 có trong các xicloankan ta lấy nhiệt đốt cháy của xicloankan đó chia cho số nguyên tử C. Hexan có sức căng góc bằng không nên nhiệt đốt cháy của nhóm CH2 khi không có sức căng góc là 157,41 kcal/mol. Từ đó ta có thể tính được nhiệt đốt cháy của các xicloankan tương ứng khi không có sức căng góc bằng cách lấy 157,41 nhân cho số nguyên tử cacbon.
Kết quả thể hiện trong bảng sau.
| n | Nhiệt đốt cháy kcal/mol | Nhiệt đốt cháy của CH2 kcal/mol | Nhiệt đốt cháy không có sức căng góc kcal/mol | Sức căng góc kcal/mol |
| 3 | 499.83 | 166.61 | 472.24 | 27.59 |
| 4 | 655.86 | 163.97 | 629.65 | 26.21 |
| 5 | 793.52 | 158.7 | 787.07 | 6.45 |
| 6 | 944.48 | 157.41 | 944.48 | 0 |
| 7 | 1108.2 | 158.31 | 1101.89 | 6.31 |
| 8 | 1269.2 | 158.65 | 1259.31 | 9.89 |
| 9 | 1429.5 | 158.83 | 1416.72 | 12.78 |
| 10 | 1586 | 158.6 | 1574.13 | 11.87 |
| 11 | 1742.4 | 158.4 | 1731.55 | 10.85 |
| 12 | 1892.4 | 157.7 | 1888.96 | 3.44 |
| 13 | 2051.4 | 157.8 | 2046.37 | 5.03 |
| 14 | 2203.6 | 157.4 | 2203.79 | -0.19 |
Nhận xét
Sức căng góc giảm dần từ xiclopropan đến xiclohexan. Vì có sự kết hợp sức căng góc (sức căng Bayer) và sự đẩy tương hỗ giữa các nhóm thế ở vị trí che khuất (sức căng Pitzer). Các vòng lớn n ³ 12 sức căng góc nhỏ không đáng kể. Các vòng trung bình (C7-C11) có sức căng góc.
(b) Entropi ảnh hưởng đến cấu dạng của vòng nhỏ. Những vòng này có khả năng đóng vòng lớn ngay cả khi có sức căng. Những vòng lớn có thể tạo ra với hiệu suất hợp lý vì chúng có sức căng góc bé và yếu tố entropi có thể vượt qua bằng sự lựa chọn điều kiện phản ứng phù hợp. Các vòng trung bình về mặt entropi và sức căng đều không thuận lợi nên hiệu suất phản ứng nhỏ.














 Trang Trước
Trang Trước





Ở bài 3 metylxiclobtuan có CTPT là C5H10 không phải C5H12
ReplyDelete