Động Hóa Học
ĐỘNG HÓA HỌC
PGS – TS Lê Kim Long, Đại học Quốc gia Hà Nội
Động hóa học nghiên cứu diễn biến của quá trình biến đổi hóa học các chất thể hiện ở: 1- Tốc độ quá trình; 2- Đường đi của quá trình hay còn gọi là cơ chế phản ứng; 3- các yếu tố ảnh hưởng đến vận tốc như nhiệt độ, môi trường ...,
Đại lượng quan trọng nhất của động hóa học là W- vận tốc phản ứng và k- hằng số vận tốc. Để thể hiện vận tốc phản ứng ta hay dùng phương trình tốc độ (định luật tốc độ) - sự phụ thuộc vận tốc vào nồng độ chất phản ứng với các khái niệm n- bậc phản ứng, m- phân tử số và n- hệ số tỷ lượng.
1. Điều kiện xảy ra phản ứng hóa học
Trong phần nhiệt động học chúng ta đã biết các khái niệm H, S, G và điều kiện để phản ứng có thể tự xảy ra.
DG < 0 º DH – TDS
Điều kiện nhiệt động học là điều kiện cần còn điều kiện đủ để phản ứng xảy ra ở mức có thể ghi nhận được lại là các điều kiện động học.
1.2. Động học:
Phản ứng chỉ có thể xảy ra nếu có va chạm giữa các phân tử có đủ năng lượng là nội dung của định luật tác dụng khối lượng hay định luật - phương trình tốc độ phản ứng (thực nghiệm):
® - k - n - n = nA + nB
W = k.
 .
. 
Theo lí thuyết phản ứng và thực nghiệm va chạm hoạt động là các va chạm giữa các hạt có đủ năng lượng vượt qua năng lượng hoạt hoá E* hay EA.
® thuyết va chạm hoạt động
- Va chạm ® va chạm hoạt động ® khái niệm E*
- Va chạm định hướng (thừa số không gian P)
2. Đường cong động học và tốc độ phản ứng
Khi xét một phản ứng, ví dụ đơn giản: chất A phản ứng tạo chất B, ta viết A ® B. Khi đó CA giảm dần, CB tăng dần theo thời gian phản ứng t. Nếu biểu diễn C theo t ta có đường cong động học.
W ® k, n ® E* ® khái niệm t1/2
 Khi đó ta có khái niệm tốc độ chuyển hoá và phản ứng:
Khi đó ta có khái niệm tốc độ chuyển hoá và phản ứng:
Tốc độ chuyển hoá chất A = -dCA/dt.
Tốc độ chuyển hoá chất B = +dCB/dt
Vận tốc phản ứng W = ±dC/dt
Trường hợp phản ứng phức tạp hơn:
W º r º số mol chất phản ứng mất đi hoặc sản phẩm hình thành/1đơn vị thời gian (t)/1 đơn vị thể tích(V).
Nếu tính tới hệ số tỷ lượng n khi cân bằng phản ứng cần chia cho n.
Giải thích dấu ± đứng trước ứng với xu hướng biến đổi nồng độ chất để đảm bảo tốc độ phản ứng luôn luôn dương
3. Các khái niệm k, n, m và phân loại phản ứng
3.1. Đơn giản:
Những phản ứng một giai đoạn (nghĩa là A, B va chạm dẫn đến sản phẩm) = phản ứng cơ bản, ví dụ:
H+ + OH- ¾® H2O
CH3-O-CH3 ® CH4 + CO + H2
n = m = n
3.2. Phức tạp: n, m không bằng nhau
Ví dụ 1: n ¹ m
CH3COCH3 + I2 ¾® CH3COCH2I + HI
Cơ chế:
a) CH3COCH3 ¾® CH3C(OH)=CH2 (chậm)
b) CH3C(OH)=CH2 + I2 ¾® CH3COCH2I + HI (nhanh)
W = Wa = ka. [CH3COCH3]1
Ta có khái niệm giai đoạn quyết định tốc độ là giai đoạn chậm nhất.
Ví dụ 2: n = m mặc dù cơ chế phức tạp
2NO + Cl2 = 2NOCl
Cơ chế:
b) NOCl2 + NO ¾® 2NOCl (chậm)
Ka =  ¾® [NOCl2] = Ka[NO] [Cl2]
¾® [NOCl2] = Ka[NO] [Cl2]
WB = kb . [NOCl2] [NO], [NOCl2] = Ka[NO] [Cl2]
= kb . Ka . [NO]2 [Cl2]
Ví dụ 3: n lẻ H2 + Br2 ¾® 2HBr
W = k [H2] [Br2]
Muốn biết nBr = ? phải xét [Br] >> hoặc << k2 [BrH]
Ví dụ 4:
Bậc ¹ n: 2N2O5 ¾® 4NO2 + O2 Þ W = k[N2O5]
2NO + O2 ¾® 2NO2 Þ W = k[NO2]2 [O2]
Ví dụ 5:





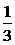











 Trang Trước
Trang Trước





No comments: