KHÁI QUÁT VỀ NHÓM OXI
KHÁI QUÁT VỀ NHÓM OXI
|
a
|
I. VỊ TRÍ NHÓM OXI TRONG BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ
- Vị trí: thuộc nhóm VIA trong bảng HTTH
- Gồm các nguyên tố: Oxi (O), lưu huỳnh (S), selen (Se), Telu (Te) và poloni (Po)
+ Oxi là nguyên tố phổ biến nhất trên trái đất, chiếm khoảng 20% thể tích không khí; ở trạng thái đơn chất, là chất khí, không màu.
+ Lưu huỳnh là chất rắn, màu vàng; có nhiều trong lòng đất
+ Selen là chất bán dẫn, màu nâu đỏ. Selen dẫn điện kém trong bóng tối, dẫn điện tốt khi được chiếu sáng.
+ Telu là chất rắn, màu xám, thuộc loại nguyên tố hiếm
+ Poloni là nguyên tố kim loại, có tính phóng xạ
II. CẤU TẠO NGUYÊN TỬ CỦA NHỮNG NGUYÊN TỐ TRONG NHÓM OXI
1. Giống nhau
Từ vị trí của các nguyên t ố trong nhóm oxi, viêt cấu hình electron và phân bố electron lớp ngoài cùng vào obitan nguyên tử.
Từ cấu hình, cho biết khuynh hướng hoá học của các nguyên tố nhóm oxi?
Từ đó, cho biết những điểm giống nhau về cấu tạo của các nguyên tố trong nhóm oxi
=> Các nguyên tố trong nhóm oxi có 6 electron lớp ngoài cùng, ở trạng thái cơ bản có 2e độc thân.
- Có khuynh hướng nhận thêm 2e để đạt cấu hình bền giống khí hiếm => Thể hiện tính oxi hoá, có số oxi hoá -2
2. Sự khác nhau giữa oxi và các nguyên tố trong nhóm
Cho biết cấu hình electron, sự phân bố e vào các obitan của nguyên tố oxi có gì khác so với các nguyên tố khác?
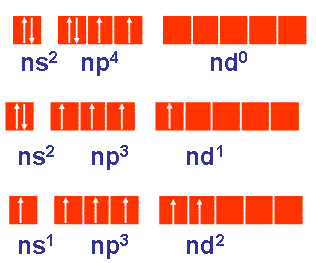
- Nguyên tố Oxi không có phân lớp d; nguyên tử của các nguyên tố còn lại có phân lớp d còn trống.
Oxi và các nguyên tố khác có thể có bao nhiêu electron độc thân?
- Ở trạng thái cơ bản, oxi và các nguyên tố còn lại có 2 electron độc thân
- Ở trạng thái kích thích, S, Se, Te có thể có 4, 6 electron độc thân ( do có phân lớp d còn trống)
Dự đoán số oxi hoá của nguyên tố oxi và các nguyên tố khác? giải thích?
- Trong hợp chất:
+ Oxi có số oxi hoá -2 ( trừ hợp chất với flo, hợp chất peoxit): do độ âm điện lớn chỉ kém flo và chỉ có 2e độc thân.
+ Các nguyên tố S, Se, Te có thể có các số oxi hoá là -2, +4, +6 ( do độ âm điện nhỏ, có thể có 2, 4, 6 e độc thân)
III. TÍNH CHẤT CỦA CÁC NGUYÊN TỐ TRONG NHÓM OXI
1. Tính chất của đơn chất
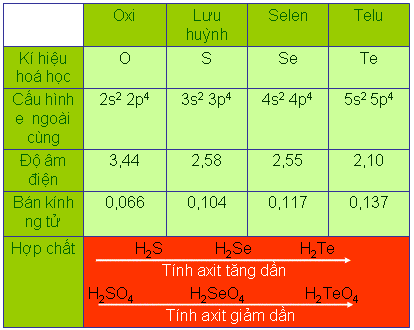
So sánh độ âm điện? bán kính nguyên tử của các nguyên tố trong nhóm oxi với các nguyên tố lân cận? Rút ra nhận xét về tính phi kim?
So sánh tính phi kim của các nguyên tố nhóm oxi với nhóm halogen?
- So với các nguyên tố khác ở cùng chu kì:
+ Độ âm điện của các nguyên tố trong nhóm oxi ( trừ Poloni) chỉ kém các nguyên tố halogen.
+ Bán kính nguyên tử của các nguyên tố (trừ Poloni) chỉ lớn hơn các nguyên tố halogen
=> Các nguyên tố trong nhóm oxi là các phi kim mạnh ( trừ nguyên tố Poloni), có tính oxi hoá mạnh ( chỉ yếu hơn các nguyên tố halogen ở cũng chu kì)
So sánh sự biến đổi tính phi kim của các nguyên tố từ Oxi đến Telu?
- Tính phi kim giảm dần từ oxi đến telu
2. Tính chất của hợp chất
Viết công thức phân tử các hợp chất của các nguyên tố nhóm oxi với hiđro? Công thức phân tử hợp chất hiđroxit của các nguyên tố nhóm oxi?
Căn cứ vào qui luật biến đổi tính chất của hiđroxit, so sánh tính axit của các hiđroxit của các nguyên tố nhóm oxi? giải thích?
Căn cứ vào bán kính nguyên tử, so sánh tính axit của các hợp chất với hiđro của các nguyên tố nhóm oxi. Giải thích?
Từ S đến Te: bán kính nguyên tử tăng dần -> khoảng cách từ tâm nguyên tử của các nguyên tử nđến tâm nguyên tử H tăng -> độ bền liên kết H-R giảm -> H càng dễ bị tách ra -> tính axit tăng dần
TÓM TẮT CẤU TẠO NGUYÊN TỬ VÀ TÍNH CHẤT CỦA CÁC NGUYÊN TỐ TRONG NHÓM OXI
|
Subscribe to:
Post Comments (Atom)






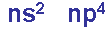

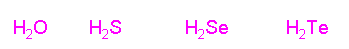


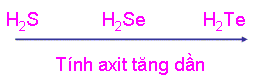

 Trang Trước
Trang Trước







No comments: