Cấu Trúc Phân Tử Và Tình Chất Hóa Học Của Hợp Chất Hữu Cơ 6
B. Thảo luận
4.0. a) Cần nắm vững định nghĩa đồng phân.
b) Xiclooctatetraen là hợp chất không thơm.
4.1. Câu "Hiệu ứng không gian của mạch nhánh làm khó cho sự proton hóa" là sai. Mạch nhánh ở A kéo dài chỉ che chắn một phía của N-piridin các phía khác vẫn thoáng, mặt khác proton dù ở dưới dạng H3O+ khi tham gia phản ứng proton hóa thì hầu như không đòi hỏi phải hoàn toàn thoáng về mặt không gian vì kích thước nhỏ bé của nó. Nguyên nhân đích thực là: Sau khi proton hóa, nhóm N+H cần được solvat hóa để khỏi kết hợp với OH-. Sự solvat hóa đòi hỏi sự tiếp cận của nhiều phân tử dung môi quanh nhóm N+H nên sẽ chịu ảnh hưởng của yế tố không gian. Ở AH+ nhóm N+H khó bị solvat hóa hơn ở BH+ do ảnh hưởng không gian của mạch nhánh.
4.2. a) Trong hỗn hợp có 12 decalon đồng phân gồm: trans-1-decalon: 2 đối quang; cis-1-decalon: 2 cặp đối quang (xem hình ở câu 2); trans-2-decalon: 2 đối quang; cis-2-decalon: 2 cặp đối quang.
b) 6 đồng phân lập thể của 1-decalon:

c). Nguyên tử Cα ở cầu nối trở thành C- và bị nghịch đảo khi kết hợp với H+. Cân bằng chuyển dịch về phía đồng phân trans bền hơn:

Cũng có thể giải thích bằng cách dựa vào dạng enol có cấu tạo phẳng .
cis-2-decalon không có sự đồng phân hóa như vậy vì Cα ở nó không phải là cầu nối, nơi quyết định cấu hình cis hoặc trans.
d). T là sản phẩm ngưng tụ, U là sản phẩm cộng Michael rồi ngưng tụ tiếp theo:

e). Ngưng tụ với EtNO2 rồi khử:

4.3.
a) A có 2 C bậc III và 8 C bậc II, không chứa vòng 3 hoặc 4 cạnh. Loại 2 vòng riêng rẽ chỉ có 1 chất gồm 2 vòng 5 cạnh nối với nhau bởi 1 liên kết đơn. Loại 2 vòng chung nhau 2 đỉnh (2 C bậc III) đỉnh thì cần sao cho tổng số C bậc 2 bằng 8 (tổng các số trong dấu [ ] bằng 8) và không tạo ra vòng 3 hoặc 4 cạnh, thí dụ: Bixiclo [4,4,0] decan; Bixiclo [5,3,0] decan; Bixiclo [4,3,1] decan; Bixiclo [5,2,1] decan; Bixiclo [4,2,2] decan; Bixiclo [3,3,2] decan.
4.4. Canxi xianamit được điều chế từ canxi cacbua và có một số phản ứng như sau:
CaC2 + N2 → CaCN2 + C (1)
CaCN2 + 3 H2O → CaCO3 + 2 NH3 (2)
CaCN2 + H2SO4 → CaSO4 + CH2N2 (3)
a) Các phản ứng 1, 2, 3 cho thấy CN2 tương có thể thay thế bởi các anion C22-, CO32-, SO42-, Vậy nó là anion CN22-, cấu tao : -N=C=N- . Phản ứng 3 thực chất là axit mạnh đẩy axit yếu ra khỏi muối, do đó suy ra CN22- có cấu tao -N=C=N- và CH2N2 có cấu tạo H-N=C=N-H.
b) Cấu trúc của 2 dạng hỗ biến của CH2N2 là:
c)
d) B có cấu trúc gon gàng, có nhiều liên kết phân cực, có nhiều nhóm tạo được liên kết hidro liên phân tử vì vậy B có nhiệt độ nóng chảy cao, tan được trong nước. B có 3N-piridin nên có lực bazơ tương tự piridin, B có 3 nhóm amino nên có tính chất tương tự amin.
e)
Các mắt xích của D có vòng thơm và các liên kết đơn C-N bền, cấu trúc của polime D thuộc loại mạng không gian. Vì vậy D là polime bền cả về hóa và cơ nhiệt. Hàm lượng % N trong D rất cao mà lại không chứa O nên khi bị cháy khí nitơ sinh ra sẽ ngăn cản không cho sự cháy tiếp tục.
4.5. a) COT có cấu trúc dạng thuyền để đảm bảo cấu tạo phẳng cho từng liên kết đôi, COT không thể ở dạng ghế được vì nguyên tử C2 và C5 không đồng phẳng với liên kết đôi C3-C4 và nguyên tử C1 và C6 không đồng phẳng với liên kết đôi C7-C8:

b)

c)

d)

4.6. Sự tách nước của A xảy ra qua giai đoạn tạo thành cacbocation kèm theo sự giải tỏa điện tích dương nên tạo ra B. Khi B bị đun nóng có thể xảy ra phản ứng Diels-Alder nội phân tử tạo thành C nhờ có phần đienophin -C6=C7- và hợp phần đien -C1=C2-C3=C4-.
Bài tập này rất hay, nó giúp rèn luyện tư duy logic biết suy luận từ phản ứng liên phân tử đến phản ứng nội phân tử.
Hiệu suất của phản ứng Diels-Alder nội phân tử kể trên không cao do hợp phần đienophin (C6=C7) và hợp phần đien (C1=C2-C3=C4) chỉ cách nhau mỗi một nguyên tử C5 nên khó sắp xếp phù hợp với yêu cầu lập thể của phản ứng Diels-Alder và vì phải tạo ra vòng 3 cạnh có sức căng lớn.
Trong trường hợp đun nóng B, phản ứng Diels-Alder bình thường (liên phân tử) tạo ra D1 và D2 có lẽ sẽ diễn ra thuận lợi hơn và tiếp theo có thể tạo ra E1 và E2:
Những hợp chất phức tạp chứa các hệ đa vòng như trên không hề xa lạ chút nào vì chúng thường có trong các loài thực vật quanh ta.
4.7. Câu dẫn của đầu bài nên sửa lại như sau: "Hãy đề nghị cơ chế phản ứng để giải thích sự tạo thành hợp chất đa vòng sau". Với đầu bài như vậy, phương pháp giải nên như sau:
● Để thấy được những liên kết mới nào được hình thành, những liên kết cũ nào bị đứt trong sự hình thành sản phẩm Z, hãy viết lại công thức của chất đầu K' thành K cho tương ứng với sản phẩm Z:

● Khi chuyển tử K sang Z ta thấy: Hai vòng 6 cạnh A và B có chung nhau cạnh a vẫn giữ được sự tương đồng; Liên kết e bị đứt, liên kết đơn d chuyển thành liên két đôi d ở Z; 2 liên kết pi ở vòng A không còn; liên kết f là liên kết mới được hình thành.
● Liên kết e bị đứt là do sự tấn công của OH- (thủy phân xúc tác bazơ). Do hiệu ứng liên hợp mà Hγ (H ở vị trí gama so với nhóm cacbonyl ở vòng A) ở xeton α,β-không no I trở thành linh động và sự enol hóa đã tạo ra enol II. Dienol II bị xeto hóa thành dixeton III.
● Xúc tác OH- không những làm thuận lợi cho quá trình enol-xeto hóa tạo thành II và III mà còn chuyển III thành cacbanion IV để thực hiện phản ứng cộng Michael vào nhóm xeton α,β-không no ở vòng A tạo thành liên kết mới f, tức là tạo ra V,VI, cuối cùng khi axit hóa thì tạo thành sản phẩm Z:
● Dixeton III là hợp chất bền, dưới tác dụng của xúc tác axit cũng có thể chuyển hóa thành Z nhưng hiệu suất thấp hơn so với xúc tác bazơ như đã trình bày ở trên.
4.8. Câu dẫn của đầu bài nên sửa lại như sau: "Hãy đề nghị cơ chế phản ứng để giải thích sự
tạo thành hợp chất đa vòng sau".
Ta chú ý rằng axit malonic mạnh hơn axit axetic nhiều (hãy giải thích điều đó) thì ta có thể tin rằng nó sẽ cung cấp proton xúc tác cho phản ứng này, và cơ chế phản ứng sẽ như sau:
Bài tập này tuy khó nhưng rất hay, nó giúp rèn luyện kĩ năng phân tích cấu trúc trong không gian ba chiều và đòi hỏi một sự hiểu biết sâu về cơ chế phản ứng.
4.9. Cấu tạo và cấu trúc của axit shikinic:




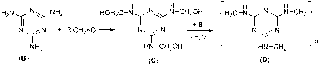






 Trang Trước
Trang Trước







No comments: