3 . Axit hữu cơ (axit cacboxylic)
3 . Axit hữu cơ (axit cacboxylic)
I. Định nghĩa Axít cacboxylic: Là một loại axit hữu cơ chứa nhóm chức cacboxyl, có công thức tổng quát là R-C(=O)-OH, đôi khi được viết thành R-COOH hoặc R-CO2H trong đó R- là gốc hydrocarbon no hoặc không no.Loại axít cacboxylic đơn giản nhất là no, đơn chức, ký hiệu R-COOH trong đó R- là gốc hydrocarbon thậm chí chỉ là 1 nguyên tử hydro.
Đồng đẳng và danh pháp
1 . Đồng đẳng
Axit cacboxylic no đơn chức là những hợp chất hữu cơ mà phân tử gồm một nhóm - COOH liên kết với gốc alkyl.
Công thức tổng quát CnH2n+1COOH (n ³ 0) Hay CmH2mO2 (m ³ 1)
Công thức tổng quát của ãit mạch hở là : CnH2n +2 – 2k –x (COOH) x
- Tên gọi
| Số nguyên tử Carbon | Tên thông dụng | Danh pháp IUPAC | Công thức cấu tạo | Thường có trong |
| 1 | Axít metanoic | HCOOH | Nọc của côn trùng | |
| 2 | Axít etanoic | CH3COOH | Giấm ăn | |
| 3 | Axít propanoic | CH3CH2COOH |
| |
| 4 | Axít butanoic | CH3(CH2)2COOH | Bơ ôi | |
| 5 | Axít pentanoic | CH3(CH2)3COOH |
| |
| 6 | Axít hexanoic | CH3(CH2)4COOH |
| |
| 7 | Axít heptanoic | CH3(CH2)5COOH |
| |
| 8 | Axít octanoic | CH3(CH2)6COOH |
| |
| 9 | Axít nonanoic | CH3(CH2)7COOH |
| |
| 10 | Axít decanoic | CH3(CH2)8COOH |
| |
| 12 | Axít dodecanoic | CH3(CH2)10COOH | Có nhiều trong dầu dừa | |
| 18 | Axít octadecanoic | CH3(CH2)16COOH |
|
Tên thay thế = tên ankan +oic
Nếu axit không no: CH2 = CH - COOH (axit acrylic)
 CH2 = C - COOH (axit metacrylic)
CH2 = C - COOH (axit metacrylic)
CH3
CH3 - (CH2)7 - CH = CH - (CH2)7 - COOH
(Cis-axit oleic)
II. Tính chất vật lí
- Các axit tan trong H2O vì tạo liên kết hiđro với H2O
- Các axit có nhiệt độ soi cao hơn hẳn so với ancol có cùng số nguyên tử C do giữa hai phân tử axit tạo được 2 liên hết hiđro.
-Axit cacboxylic là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl ( -COOH) liên kết trực tiếp với nguyện tử cacbon hoặc nguyên tử hiđro.
III. Tính chất hóa học
1. Tính axit:
- Axit cacboxylic điện li không hoàn toàn trong nước theo cân bằng:
(Ka là mức đo lực axit, Ka càng lớn thì axit càng mạnh và ngược lại)
- Axit cacboxylic là một axit yếu. Tuy vậy, chúng có đủ tính chất của 1 axit: làm quỳ tím hóa đỏ, tác dụng được với kim loại giải phóng hiđro, với oxit kim loại, với bazơ, với muối và rượu.
HCOOH +Na à HCOONa +1/2 H2
2CH3COOH +MgO à (CH3COO)2Mg +H2O
2CH2=CH –COOH +Na2CO3 à2CH2CH –COONa +CO2+H2O
- Trong các axit no đơn chức, axit fomic (HCOOH) mạnh hơn cả. Các nhóm ankyl đẩy electron về phía nhóm cacboxyl nên làm giảm lực axit. Các nguyên tử có độ âm điện lớn ở gốc R hút electron của nhóm cacboxyl .
2 Phản ứng với ancol ( phản ứng este hóa )
3. Phản ứng tách nước liên phân tử:
Khi cho tác dụng với P2O5. hai phân tử axit tách đi một phân tử nước tạo thành phân tử anhiđrit axit:
4. Phản ứng thế ở gốc no.
Khi dùng photpho xúc tác, Cl chỉ thế cho H ở cacbon bên cạnh nhóm cacboxyl
5. Phản ứng thế ở Cacbon
Cl

CH3 - CH2 - COOH + Cl2
 CH3 - CH - COOH + HCl
CH3 - CH - COOH + HCl
6. Phản ứng thế ở gốc thơm.
Nhóm cacboxyl ở vòng benzen định hướng cho phản ứng thế tiếp theo vào vị trí meta làm cho phản ứng khó khăn hơn so với thế vào benzen.
7. Phản ứng đặc biệt của gốc R:
+ Nếu HOOH có khả năng tham gia tráng bạc:
HOOH +2AgNO3 + 4NH3 →( NH4 )2CO3 + 2Ag + 2NH4NO3
+R có nối đôi , thì có phản ứng tham gia trùng hợp, cộng, oxi hóa
Axit chưa no còn cho phản ứng cộng, trùng hợp.
CH2=CH –COOH +H2O à HO –CH2 –CH2 –COOH
+Ngoài ra axit có khả năng tham gia phản ứng trùng ngưng:
IV. Điều chế
1. Oxi hóa anđêhit tương ứng Oxi hóa hiđrocacbon, ancol, andehyt tương ứng:
+Oxi hóa rượu bậc I tương ứng:
5CH2 –CH2OH + 4KMnO4 + 6H2SO4 à 5CH3COOH + 2K2SO4+4MnSO4+11H2O
+Oxi hóa hiđrocacbon chưa no:
5CH3 –CH = CH –CH3 +8KMnO4+12H2SO4à 10CH3COOH + 4K2SO4+8MnSO4 +12H2O
+Oxi hóa ankan thích hợp:
CH3 - CH2 - CHO +  O2
O2  CH3 - CH2 - COOH
CH3 - CH2 - COOH
2. Riêng CH3COOH còn thêm các phương pháp điều chế khác như sau:
a. Lên men giấm
b. Tổng hợp từ C2H2
3 . R -C≡N + 2H2O →RCOOH + NH3







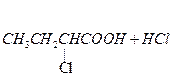












 Trang Trước
Trang Trước





No comments: