CÂU 1 trong đề Olympic Hóa 10 – p.1
BÀI TẬP GỢI Ý
Một số vấn đề cần ôn tập
(Học sinh làm và phân dạng các bài tập tương tự trong các đề thi Olympic 30/4)
CÂU 1 trong đề Olympic Hóa 10 – p.1
NỘI DUNG:
Chương I: CẤU TẠO NGUYÊN TỬ
1. Thành phần cấu tạo nguyên tử
- Hạt nhân nguyên tử
Độ hụt khối. Năng lượng liên kết của hạt nhân. Phản ứng hạt nhân. Động học quá trình phân rã phóng xạ.
- Vỏ nguyên tử
Obitan nguyên tử. Năng lượng electron. Cấu hình electron nguyên tử và ion. Ý nghĩa 4 số lượng tử. Đặc điểm lớp electron ngoài cùng
Chương II:
BẢNG TUẦN HOÀN VÀ ĐỊNH LUẬT TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. Cấu tạo bảng tuần hoàn các nguyên tố hóa học (Số thứ tự, chu kì, nhóm nguyên tố, khối nguyên tố) liên hệ với cấu hình electron nguyên tử.
- Định luật tuần hoàn. Sự biến thiên cấu hình electron nguyên tử, một số đại lượng vật lí, tính chất các nguyên tố, thành phần và tính chất của các hợp chất.
Chương III: LIÊN KẾT HÓA HỌC
1. Đại cương về liên kết hóa học (liên kết cộng hóa trị, ion, kim loại).
- Cấu tạo và dạng hình học phân tử : thuyết VB, thuyết VSERP, thuyết lai hóa, thuyết MO.
- Liên kết hiđro. Tương tác Van der Waals. Sự phân cực của phân tử.
- Mạng lưới tinh thể ion, phân tử, nguyên tử, kim loại. Cách xác định số đơn vị cấu trúc trong một ô mạng cơ bản, độ đặc khít.
A- Cấu tạo nguyên tử
Câu 1. Hai nguyên tố M, X thuộc cùng chu kỳ và đều thuộc nhóm A. Tổng số proton của M và X bằng 28. Hợp chất của M và X với hidro có chứa cùng số nguyên tử hidro trong phân tử. Khối lượng nguyên tử M nhỏ hơn khối lượng nguyên tử X.
a) Viết công thức oxit, hidroxit có hóa trị cao nhất của M, công thức hợp chất tạo bởi 2 oxit của M và X.
b) Xác định M, X biết hợp chất P tạo bởi 2 oxit của M và X ,trong P có chứa 53,33% lượng oxi và 20% lượng của 1 trong 2 nguyên tố còn lại.
Câu 2. Tổng số các hạt của một nguyên tố X bằng 108.
a) Hỏi nguyên tố X thuộc chu kỳ nào của bảng tuần hoàn?
b) Xác định cấu hình electron của X, biết X ở nhóm VA và có số Z < 82
Câu 3. Cấu hình electron ngoài cùng của nguyên tử của một nguyên tố X là 5p5. Tỷ số nơtron và điện tích hạt nhân bằng 1,3962. Số nơtron của X bằng 3,7 lần số nơtron của nguyên tử thuộc nguyên tố Y. Khi cho 4,29 gam Y tác dụng với lượng dư X thì thu được 18,26 gam sản phẩm có công thức XY. Hãy xác định điện tích hạt nhân của X, Y và viết cấu hình electron của Y tìm được, xác định vị trí của X,Y trên bảng tuần hoàn.
Câu 4. Xác định nguyên tử mà electron cuối cùng điền vào có các số lượng tử sau:
a) n = 2 ; l = 1 ; m = 0 ; s = +
b) n = 3 ; l = 2 ; m = 0 ; s = –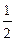
Phản ứng hạt nhân
Câu 1. a/  Ra có chu kỳ bán huỷ là 1590 năm. Hãy tính khối lượng của một mẫu Ra có cường độ phóng xạ = 1Curi (1 Ci = 3,7. 1010 Bq )?
Ra có chu kỳ bán huỷ là 1590 năm. Hãy tính khối lượng của một mẫu Ra có cường độ phóng xạ = 1Curi (1 Ci = 3,7. 1010 Bq )?
l) Hãy thay mỗi dấu (?) bằng các kí hiệu thích hợp và viết phương trình phản ứng hạt nhân cho mỗi biến đổi trong dãy sau :
 U
U  ? +
? +  Th
Th 
 Pa + ?
Pa + ?  b – + ?
b – + ? 
 He + ?
He + ?
(1) (2) (3) (4)
Câu 2. a) Hãy tính xem trong bao nhiêu năm thì 99,9% số nguyên tử phóng xạ X bị phân huỷ, cho biết chu kỳ bán huỷ của X là 50 năm.
b) Tương tự với : - 80%; T1/2 = 750 năm.
c) Biết chu kỳ bán huỷ của Ra là 1620 năm. Sau bao lâu 3 gam Ra giảm chỉ còn 0,375 gam
Câu 3. Một mẫu than lấy từ hang động ở vùng núi đá vôi tỉnh Hoà Bình có 9,4 phân huỷ 14C. hãy cho biết người Việt cổ đại đã tạo ra mẫu than đó cách đây bao nhiêu năm ? Biết chu kỳ bán huỷ của 14C là 5730 năm, trong khí quyển có 15,3 phân huỷ 14C (tính với 1 gam C xảy ra trong 1 giây).
Câu 4. Một mẫu đá chứa 17,4 mg 238U và 1,45 mg 206Pb. Biết rằng chu kỳ bán huỷ của 238U là
4,51. 109 năm. Hãy tính thời gian tồn tại của mẫu đá đó.
B-Tinh thể
Câu 1. Kim loại Paladi kết tinh trong mạng lưới lập phương tâm diện. Cạnh của tế bào sơ đẳng a = 3,88A ở 200C.
a) Hãy vẽ cấu trúc của tế bào sơ đẳng.
b) Cho biết số nguyên tử Pd trong một tế bào sơ đẳng.
c) Tính khoảng cách ngắn nhất giữa 2 nguyên tử Pd.
d) Có bao nhiêu nguyên tử láng giềng gần nhất (có khoảng cách bằng khoảng cách ngắn nhất trên) bao quanh một nguyên tử đã cho.
e) Tính khối lượng riêng của Pd (Pd = 106,4).
Câu 2. Phân tử CuCl kết tinh dưới dạng lập phương tâm diện. Hãy biểu diễn mạng cơ sở củaCuCl.
a) Tính số ion Cu+ và Cl – rồi suy ra số phân tử CuCl chứa trong mạng tinh thể cơ sở.
b) Xác định bán kính ion Cu+.
Cho: d(CuCl) = 4,136 g/cm3 ; rCl = 1,84 Å ; Cu = 63,5 ; Cl = 35,5
Câu 3. Tính bán kính ion Cs+ với giả thiết là trong tinh thể CsCl, các ion tiếp xúc nhau dọc theo đường chéo của ô mạng cơ sở. Biết bán kính ion Cl- 1,81A và độ dài cạnh ô mạng cơ sở CsCl bằng 4,121A.
Câu 4. a) Hãy vẽ sơ đồ mô tả cấu trúc của một tế bào sơ đẳng của kim cương.
b) Biết hằng số mạng a = 3,5 Å, hãy tính khoảng cách giữa một nguyên tử C và một nguyên tử C gần nhất. Mỗi nguyên tử C như vậy được bao quanh bởi mấy nguyên tử ở khoảng cách đó?
c) Hãy tính số nguyên tử C trong một tế bào sơ đẳng và khối lượng riêng của kim cương.
Câu 5. Silic có cấu trúc tinh thể giống kim cương với thông số mạng a = 0,534nm. Tính bán kính nguyên tử cộng hóa trị của silic và khối lượng riêng (g.cm-3) của nó. Cho biết MSi = 28,086g.mol-1. Kim cương có cấu trúc lập phương tâm mặt (diện), ngoài ra còn có 4 nguyên tử nằm ở 4 hốc (site) tứ diện của ô mạng cơ sở.
C- Liên kết hóa học- Hình học phân tử
Câu 1. Hợp chất A có tổng số electron trong phân tử bằng 100. A được tạo thành từ 2 nguyên tố phi kim thuộc các chu kỳ nhỏ và thuộc 2 nhóm khác nhau. Xác định công thức phân tử A, biết rằng tổng số nguyên tử 2 nguyên tố trong phân tử A là 6. Hãy mô tả cấu trúc của A.
Câu 2. Cho các trị số góc liên kết: 100,30; 97,80; 101,50; 1020 và các góc liên kết  ;
;  ;
;  ;
;  . Hãy gán trị số cho mỗi góc liên kết và giải thích.
. Hãy gán trị số cho mỗi góc liên kết và giải thích.
Câu 3. a/ Viết cấu trúc Lewis của NO2 và nêu dạng hình học của nó. Dự đoán dạng hình học của ion NO2- và ion NO2+. So sánh hình dạng của 2 ion với NO2.
b/ Năng lượng liên kết của BF3 = 646 kJ/mol còn của NF3 chỉ = 280 kJ/mol. Giải thích sự khác biệt về năng lượng liên kết này.
c/ Điểm sôi của NF3 = -1290C còn của NH3 = -330C. Amoniac tác dụng như một bazơ Lewis còn NF3 thì không. Momen lưỡng cực(µ) của NH3= 1,46D lớn hơn nhiều so với µ(NF3) = 0,24D mặc dù độ âm điện của F lớn hơn nhiều so với H. Hãy giải thích.
Câu 4. 17. a) Tại sao trong các phân tử H2O,NH3 các góc liên kết  (104,290) và
(104,290) và  (1070) lại nhỏ hơn góc tứ diện (1090,28')
(1070) lại nhỏ hơn góc tứ diện (1090,28')
b) Xét 2 phân tử H2O và H2S tại sao góc  (92015') lại nhỏ hơn
(92015') lại nhỏ hơn  (104029')
(104029')
c) Xét 2 phân tử H2O và F2O tại sao góc  (103015') lại nhỏ hơn
(103015') lại nhỏ hơn  (104029')
(104029')
Câu 5. Hãy cho biết: cấu tạo lewis; dạng lai hóa(nếu có); hình dạng phân tử theo mô hình VSEPR; của mỗi phân tử sau: SF4; HClO2; HOCl; ICl ; IF7; BrF5; HNO3; C2H6, BeH2, BF3, PCl5, XeF4
; IF7; BrF5; HNO3; C2H6, BeH2, BF3, PCl5, XeF4

 Trang Trước
Trang Trước



No comments: