MỘT SỐ BÀI THÍ NGHIỆM THỰC HÀNH THEO CHƯƠNG TRÌNH OLYMPIC 8
Bài 8. Tổng hợp và phân tích Aspirin
Lí thuyết
Nghe
Đọc ngữ âm
Từ điển - Xem từ điển chi tiết
Nghe
Đọc ngữ âm
Từ điển - Xem từ điển chi tiết
Aspirin, acid acetylsalicylic là một axit hữu cơ có chứa cả este hữu cơ. Nó được sử dụng rộng rãi trong y học như một loại thuốc giảm đau và như một loại thuốc giảm sốt. Nó thường được điều chế bằng phản ứng của axit salixylic với anhydrit axetic theo phản ứng sau:
axit Salixylic anhydrit axetic axit axetyl salixylic axit axetic
Một lượng axit axetylsalixylic có thể được xác định bởi sự chuẩn độ với một bazơ mạnh như Natri hyđroxit
CH3COO-C6H4COOH(aq) + OH-(aq) → CH3COOC6H4COO-(aq) + H2O(l)
Tuy nhiên, axit axetylsalixylic cũng là một este nên dễ dàng bị thủy phân khi chuẩn độ với một bazơ mạnh, do đó trong môi trường kiềm nó bị phân hủy dẫn đến sai sót trong sự phân tích. Như vậy, khi áp dụng phương pháp chuẩn độ thì tất cả axit có mặt trong dung dịch sẽ thủy phân hoàn toàn trong NaOH dư. Một mol axit trong aspirin phản ứng vừa đủ với một mol NaOH, một mol este trong aspirin phản ứng vừa đủ với một mol NaOH. Như vậy số mol NaOH phản ứng sẽ gấp đôi số mol aspirin, sau đó lượng NaOH thừa sẽ được chuẩn độ với dung dịch axit chuẩn. Trong thí nghiệm này, axit acetylsalicylic sẽ được chuẩn bị, tổng lượng acid có mặt sẽ được xác định bằng cách sử dụng một phương pháp chuẩn độ lại.
Hóa chất và Thuốc thử
- axit Salixylic HOC6H4COOH
- anhydrit axetic (CH3CO)2º
- axit photphoric H3PO4 và axit sunfuric đậm đặc
- Etanol C2H5OH
- Natri hyđroxit NaOH 0,50 mol.L-1.
- axit clohyđric HCl 0,30 mol.L-1.
- Chất chỉ thị phenolphtalein.
| Chất | Trạng thái | Kí hiệu R | Kí hiệu S |
| CH3CO2C6H4CO2H | Chất rắn | 22 36 37 38 41 61 | 22 26 36 37 39 |
| CH3C2O3CH3 | Chất lỏng | 10 20 22 34 | 26 36 37 39 45 |
| H3PO4 | Đậm đặc | 23 24 25 35 36 37 38 49 | 23 30 36 37 39 45 |
| H2SO4 | Đậm đặc | 23 24 25 35 36 37 38 49 | 23 30 36 37 39 45 |
| C2H5OH | Chất lỏng | 11 20 21 22 36 37 38 40 | 7 16 24 25 36 37 39 45 |
| NaOH(aq) | 0.50 mol·L-1 | 35 | 26 37 39 45 |
| HCl(aq) | 0.30 mol·L-1 | 23 25 34 38 | 26 36 37 39 45 |
Thiết bị và Đồ thủy tinh
| • cốc, 100 ml, | • phễu Buchner |
A. Tổng hợp Aspirin, axit axetylsalixylic
1. Cân chính xác 3,00 gam axit salixylic trong bình tam giác định mức 100 mL
2. Thêm 6,00 mL anhyđrit axetic và 4 – 8 giọt axit photphoric vào bình và khuấy, trộn kỹ
3. Đun nóng dung dịch đến khoảng 80 – 100oC bằng cách đặt bình trong nước nóng khoảng 15 phút.
4. Thêm từng giọt 2,0 ml nước lạnh cho đến khi anhydrit axetic phân hủy hoàn toàn và sau đó thêm 40 mL nước và làm mát dung dịch trong bình nước đá. Nếu tinh thể không xuất hiện, dùng thanh khuấy cà vào thành bình để tạo ra kết tinh.
5. Dùng giấy lọc để sử dụng lọc. Lọc chất rắn bằng cách lọc hút thông qua phễu Buchner và rửa các tinh thể với vài ml nước đá lạnh vào khoảng - 5oC.
6. Để kết tinh lại, bằng cách hòa tan các tinh thể vào cốc và thêm 10 ml etanol, sau đó thêm 25 ml nước ấm.
7. Đậy cốc bởi miếng kính đồng hồ và khi sự kết tinh đã bắt đầu thì đặt cốc trong bình nước đá để hoàn tất sự kết tinh lại.
8. Áp dụng hút lọc như mô tả trong bước 5.
9. Đặt các sản phẩm vào giấy lọc với miếng kính đồng hồ và sấy khô ở 100 ° C trong khoảng 1 giờ rồi xem xét sản phẩm.
10. Xác định điểm nóng chảy (135 ° C) để xác minh độ tinh khiết.
B. Xác định lượng axit acetylsalicylic
1. Hòa tan 0,5 g aspirin vào 15 ml etanol trong một bình tam giác 250 ml.
2. Thêm 20 mL dung dịch NaOH 0.50 mol·L-1.
3. Để tăng tốc độ phản ứng thủy phân, đun nóng các mẫu trong một cốc nước khoảng 15 phút sau khi bổ sung hai hoặc ba chip sôi vào bình xoáy trên bình thỉnh thoảng.
Chú ý: Tránh đun sôi, bởi vì các mẫu có thể bị phân hủy.
4. Làm lạnh mẫu đến nhiệt độ phòng và thêm 2- 4 giọt chỉ thị phenolphtalein vào bình. Màu sắc của dung dịch là màu hồng nhạt. Nếu dung dịch không màu thì thêm 5 ml dung dịch NaOH 0,50 mol. L-1 rồi lặp lại các bước 3 và 4.
5. Ghi lại tổng khối lượng dung dịch NaOH 0,50 mol.L-1 được thêm vào.
6. Chuẩn độ bazơ thừa trong dung dịch bằng dung dịch HCl 0,30 mol.L-1 cho đến khi màu hồng biến mất và dung dịch trở nên đục.
7. Ghi lại khối lượng dung dịch HCl 0,30 mol.L-1 được thêm vào.
8. Lặp lại các bước của sự chuẩn độ hai lần nữa bằng cách sử dụng hai mẫu mới.
Xử lý dữ liệu
1. Tính hàm lượng của Aspirin chuẩn bị:
Axit salixylic Anhyđrit axetic Axit axetylsalixylic Axit axetic
Khối lượng aspirin theo lý thuyết:
n(salicylic acid) =  = 0,0217 mol, n(aspirin) = 0,0217 mol
= 0,0217 mol, n(aspirin) = 0,0217 mol
Khối lượng aspirin = 0.0217×180,2 = 3.906 g
Thực nghiệm:
Khối lượng sản phẩm khô (aspirin) thu được theo thực nghiệm = 3,03 g n(aspirin) hay 3,03/180,2 = 0,01682 mol
Hàm lượng thấp do độ tan của aspirin trong nước lạnh
2. Tính lượng axit axetylsalixylic có trong mẫu asppirin
n(axit axetylsalixylic) theo lý thuyết= 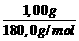 = 5.55 mmol
= 5.55 mmol
40 ml NaOH 0,5 M chứa 20 mmol
Chuẩn độ 1,00 g mẫu với HCl 0.30 M, thực nghiệm dùng trung bình 27.0 ml
27 ml HCl 0,3M chứa 8,10 mmol
n(NaOH dùng phản ứng với axit axetylsalixylic) = 20.0 - 8.10 = 11.9 mmol
1,0 mol axit axetylsalixylic phản ứng với 2,0 mol NaOH nên
n (axit axetylsalixylic) =  = 5.95 mmol
= 5.95 mmol
Để loại bỏ axit axetic tạo ra sau phản ứng, quá trình kết tinh lại (tái kết tinh) được lặp đi lặp lại
và rửa sạch mẫu bằng nước dư. Do đó lượng mẫu giảm từ 1,50 g đến 1,05 g.
Trong sự chuẩn độ tái kết tinh 1,00 g mẫu với HCl 0.30 M, thực nghiệm dùng trung bình 28.9 ml.
28,9 ml HCl 0,30M chứa 8,67 mmol
n(NaOH dùng phản ứng với axit axetylsalixylic) = 20,0 - 8,67 = 11,3 mmol
1,0 mol axit axetylsalixylic phản ứng với 2,0 mol NaOH nên
n (axit axetylsalixylic) =  = 5,67 mmol
= 5,67 mmol
3. Tính độ tinh khiết của aspirin và biểu thị bằng tỷ lệ phần trăm khối lượng
Điểm nóng chảy của mẫu là 132oC chỉ ra rằng mẫu không tinh khiết. Khối lượng axit axetylsalixylic tìm thấy trong (b) nhiều hơn so với lý thuyết chỉ ra rằng phương pháp tính cho thấy không chỉ axit axetylsalixylic mà còn axit salixylic và sản phẩm phụ axit axetic cũng không phản ứng. Vì vậy nó sẽ ảnh hưởng đến độ tinh khiết của mẫu aspirin.




 Trang Trước
Trang Trước



No comments: