ĐỀ CƯƠNG ÔN TẬP HÓA 10- NC Học kì I
Học kì I- Năm học : 2012-2013
1. Các hạt cấu tạo nên hầu hết các nguyên tử là
A. Electron và proton. B. Proton và nơtron.
C. Nơtron, electron và proton. D. Nơtron và electron.
2. Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là:
A. Electron và proton. B. Nơtron và electron.
C. Nơtron và proton. D. Proton, nơtron và electron.
3. Phát biểu nào dưới đây không đúng?
A. Nguyên tử là một hệ thống trung hoà điện.
B. Trong nguyên tử hạt nơtron và hạt proton có khối lượng xấp xỉ nhau.
C. Trong một nguyên tử, nếu biết số proton có thể suy ra số nơtron.
D. Trong một nguyên tử, nếu biết số proton có thể suy ra số electron.
4. Phát biểu nào dưới đây không đúng?
A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, nơtron và electron.
B. Hạt nhân nguyên tử được cấu thành từ các hạt proton và nơtron.
C. Vỏ nguyên tử được cấu thành bởi các hạt electron.
D. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử.
5. Trong hạt nhân nguyên tử, hạt mang điện tích là
A. Proton. B. Electron và proton. C. Proton và nơtron. D. Nơtron.
6. Trong một nguyên tử:
A. Số proton luôn bằng số nơtron.
B. Tổng điện tích các proton và electron bằng điện tích hạt nhân.
C. Số khối A là khối lượng tuyệt đối của nguyên tử.
D. Tổng số proton và số nơtron được gọi là số khối.
7. Trong các hạt sau đây, hạt nào mang không điện tích?
A. Electron. B. Nơtron. C. Electron và proton. D. Proton.
8. Nguyên tử nguyên tố R có tổng số hạt mang điện và không mang điện là 34, trong đó só hạt mang điện gấp 1,833 lần số hạt không mang điện. R là nguyên tử nào dưới đây?
A. Na. B. Mg. C. F. D. Ne.
9. Phát biểu nào dưới đây là đúng với nguyên tử X có số hiệu nguyên tử là 9?
A. Điện tích của lớp vỏ nguyên tử của X là 9+. B. Điện tích hạt nhân nguyên tử X là 9+.
C. Tổng số hạt trong nguyên tử X là 26. D. Số khối của nguyên tử X là 17.
10. Số hiệu nguyên tử của các nguyên tố cho biết:
A. số electron hoá trị và số nơtron. B. số proton trong hạt nhân và số nơtron.
C. số electron trong nguyên tử và số khối. D. số electron và số proton trong nguyên tử.
11. Biết số Avogađro bằng 6,022.1023. Tính số nguyên tử H có trong 1,8 gam H2O.
A. 0,2989.1023. B. 0,3011.1023. C. 1,2044.1023. D. 10,8396.1023.
12. Nguyên tố hóa học là những nguyên tử có cùng
A. số khối. C. số nơtron. D. số nơtron và proton. B. số proton.
13. Kí hiệu nguyên tử biểu thị đấy đủ đặc trưng cho một nguyên tử của một nguyên tố hóa học vì nó cho biết
A. số khối A. B. số khối A và số đơn vị điện tích hạt nhân.
C. số hiệu nguyên tử Z. D. nguyên tử khối của nguyên tử.
14. Phát biểu nào dưới đây không đúng?
A. Số khối bằng khối lượng của hạt nhân nguyên tử tính ra u (đvC).
B. Số khối là số nguyên. C. Số khối bằng tổng số hạt proton và nơtron
D. Số khối kí hiệu là A.
15. Tổng số hạt proton, nơtron và electron trong một nguyên tử nguyên tố X là 155, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. X là nguyên tố nào dưới đây?
A. Cu. B. Ag. C. Fe. D. Al.
16. Một nguyên tử X có tổng số các loại hạt là 40. Số hạt mang điện nhiều hơn số hạt không mang điện là 12 hạt. Số khối X là
A. 38. B. 52. C. 40. D. 27.
17. Một nguyên tử có tổng số các loại hạt là 40. Đó là nguyên tử của nguyên tố nào sau đây?
A. Al. B. Ca. C. Ar. D. Na.
18. Nguyên tử nào trong các nguyên tử sau đây chứa đồng thời 20 nơtron, 19 proton và 19 electron?
19. Biết số Avogađro bằng 6,022.1023. Số nguyên tử H có trong 1,8 gam H2O là:
A. 0,3011.1023 nguyên tử. B. 1,2044.1023 nguyên tử.
C. 6,0220.1023 nguyên tử. D. 10,8396.1023 nguyên tử.
20. Nguyên tố R có tổng số hạt (e, p, n) trong nguyên tử là 58. Trong đó tổng số hạt mang điện tích dương ít hơn hạt không mang điện là 4. Vậy nguyên tử khối của R là:
A. 40. B. 36. C. 44. D. 18.
21. Nguyên tử X có tổng số các hạt bằng 60, trong đó số hạt nơtron bằng số hạt proton. X là nguyên tử nào dưới đây?
22. Số proton, nơtron và electron của  lần lượt là:
lần lượt là:
A. 19, 20, 39. B. 20, 19, 39. C. 19, 20, 19. D. 19, 19, 20.
23. Một nguyên tử X có tổng số các hạt là 115, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt. Số khối của nguyên tử X là:
A. 82. B. 148. C. 78. D. KQK.
24. Nguyên tử nguyên tố X có số điện tích hạt nhân bằng 13, số khối bằng 27 thì số nơtron bằng
A. 13. B. 27. C. 14. D. 40.
25. Nguyên tử  có số proton, electron và nơtron lần lượt là:
có số proton, electron và nơtron lần lượt là:
A. 19, 20, 39. B. 19, 20, 19. C. 20, 19, 39. D. 19, 19, 21.
26. Tổng số hạt p, n trong nguyên tử  là:
là:
A. 49. B. 86. C. 123. D. 27.
27. Số proton, electron, nơtron trong ion  lần lượt là:
lần lượt là:
A. 17, 18, 18. B. 17, 19, 18. C. 17, 18, 35. D. 17, 35, 18.
28. Số p, n, e của ion  lần lượt là:
lần lượt là:
A. 24, 28, 24. B. 24, 30, 21. C. 24, 28, 21. D. 24, 28, 27.
29. Tổng số hạt n, p, e trong  là:
là:
A. 52. B. 35. C. 53. D. 51.
A. 26, 30, 23. B. 24, 28, 21. C. 24, 30, 21. D. 24, 28, 27.
31. Nguyên tử  có số hạt mang điện nhiều hơn số hạt không mang điện là:
có số hạt mang điện nhiều hơn số hạt không mang điện là:
A. 45. B. 25. C. 10. D. 35.
32. Nguyên tử R có tổng số hạt là 115 và có số khối là 80. Suy ra điện tích hạt nhân Z của R là:
A. 35. B. 65. C. 40. D. 195.
33. Một nguyên tử X có tổng số các hạt là 10. Số khối của X là:
A. 6. B. 7. C. 8. D. 10.
34. Có bao nhiêu nguyên tử hiđro trong 0,46 gam C2H5OH ( Cho biết số avogađro bằng 6.1023 )?
A. 6 x 1020. B. 1,2 x 1021. C. 3 x 1021. D. 3,6 x 1022 .
35. Chọn kí hiệu đúng của nguyên tử X biết:
Nguyên tử X có tổng số hạt cơ bản ( P, N và E ) là 24, số hạt không mang điện chiếm 33,33%
36. Ba nguyên tử X, Y, Z có tổng số điện tích hạt nhân bằng 16, hiệu điện tích hạt nhân X và Y là 1. Tổng số electron trong ion (X3Y)- là 32. X, Y, Z lần lượt là:
A. O, S, H. B. C, H, F. C. O, N, H. D. N, C, H.
37. Trong tự nhiên oxi có 3 đồng vị bền:  còn cacbon có 2 đồng vị bền
còn cacbon có 2 đồng vị bền  . Số lượng phân tử CO2 tạo thành từ các đồng vị trên là:
. Số lượng phân tử CO2 tạo thành từ các đồng vị trên là:
A. 10. B. 12. C. 11. D. 13.
38. Trong tự nhiên, đồng có 2 đồng vị 63Cu và 65Cu, trong đó đồng vị 65Cu chiếm 27,0% về số nguyên tử. Phần trăm khối lượng của 63Cu trong Cu2O là giá trị nào sau đây?
A. 88,82% . B. 63,0%. C. 32,15%. D. 64,29%.
39. Oxi có 3 đồng vị  . Chọn câu trả lời đúng?
. Chọn câu trả lời đúng?
A. Số proton của chúng lần lượt là 8, 9, 10. B. Số nơtron của chúng lần lượt là 16, 17, 18.
C. Số nơtron của chúng lần lượt là 8, 9, 10.
D. Trong mỗi đồng vị số nơtron lớn hơn số proton.
40. Tỉ lệ về số nguyên tử của 2 đồng vị A và B trong tự nhiên của nguyên tố X là 27: 23. Trong đó đồng vị A có 35 proton và 44 nơtron, đồng vị B có nhiều hơn đồng vị A là 2 nơtron. Nguyên tử khối trung bình của X là giá trị nào dưới đây?
A. 79, 92. B. 81, 86. C. 80, 01. D. 79,91.
41. Đồng có 2 đồng vị là 63Cu và 65Cu ( chiếm 27%). 0,5 mol Cu có khối lượng là:
A. 31,77 gam. B. 32 gam. C. 31,5 gam. D. 32,5 gam.
42. Nguyên tố X có hai đồng vị có số khối lần lượt là 79 và 81. Khối lượng nguyên tử trung bình của X là 79,91 đvc. Phần trăm của mỗi đồng vị tương ứng là
A. 50%, 50%. B. 54,5%, 45,5%.
C. 45,5%, 54,5%. D. 72,3%, 27,7%.
43.Trong tự nhiên Agon có 3 đồng vị: 36Ar(0,337%); 38Ar(0,063%): 40Ar(99,6%).Cho rằng nguyên tử khối của các đồng vị trùng với số khối của chúng. Thể tích của 20 gam Agon (đktc) bằng:
A. 112 dm3. B. 22,4 dm3. C. 11,2 dm3. D. 1,12 dm3.
44. Nguyên tố X có hai đồng vị, đồng vị thứ nhất có số khối là 24 và chiếm 60%. Khối lượng nguyên tử trung bình của X bằng 24,4. Số khối của đồng vị thứ hai của X là:
A. 26. B. 25. C. 27. D. 23.
45. Cacbon có các đồng vị : 12C và 13C ; oxi có các đồng vị: 16O , 17O và 18O. Số công thức của các
loại phân tử CO2 khác nhau là
A. 10. B. 9. C. 12. D. 8.
46. Trong tự nhiên, đồng có 2 đồng vị  và
và  , trong đó đồng vị
, trong đó đồng vị  chiếm khoảng 27% về khối lượng. Phần trăm khối lượng của
chiếm khoảng 27% về khối lượng. Phần trăm khối lượng của  trong Cu2O là:
trong Cu2O là:
A. 73%. B. 32,15%. C. 63%. D. 64,29.
47. Cacbon có 2 đồng vị  và
và  , còn oxi có 3 đồng vị
, còn oxi có 3 đồng vị  ,
,  và
và  . Các công thức hóa học có thể có của khí cacbonic là:
. Các công thức hóa học có thể có của khí cacbonic là:
A. 3. B. 6. C. 9. D. 12.
48. Trong tự nhiên Br có 2 đồng vị  ( 54,5%) và
( 54,5%) và  ( 45,5%). Nguyên tử khối ( số khối ) trung bình của Br là:
( 45,5%). Nguyên tử khối ( số khối ) trung bình của Br là:
A. 80. B. 79,91. C. 35. D. 79,92..
49. Nguyên tử X, Y, Z có kí hiệu lần lượt:  ,
,  ,
, . X, Y, Z là:
. X, Y, Z là:
A. ba đồng vị của cùng một nguyên tố. B. các đồng vị của ba nguyên tố khác nhau.
C. ba nguyên tử có cùng số nơtron. D. ba nguyên tố có cùng số khối.
50. Nguyên tố X có 3 đồng vị:  ( 92,3%);
( 92,3%);  (4,7%);
(4,7%);  (3%). Tổng số khối của 3 đồng vị này là 87. Số nơtron trong đồng vị
(3%). Tổng số khối của 3 đồng vị này là 87. Số nơtron trong đồng vị  nhiều hơn trong
nhiều hơn trong  là 1 hạt. Số khối trung bình của 3 đồng vị là 28,107. Giá trị A3 là:
là 1 hạt. Số khối trung bình của 3 đồng vị là 28,107. Giá trị A3 là:
A. 28. B. 29. C. 30. D. 31.
51. Trong tự nhiên, Cu tồn tại với hai loại đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của Cu bằng 63,546. Số nguyên tử 63Cu có trong 32 gam Cu là (biết số Avogađro= 6,022.1023).
A. 3,012.1023. B. 12,046.1023. C. 2,205.1023. D. 1,503.1023.
52. Hiđro có 3 đồng vị:  và Oxi có 3 đồng vị
và Oxi có 3 đồng vị  ;
;  ;
;  . Có bao nhiêu loại phân tử H2O cấu tạo từ các đồng vị trên?
. Có bao nhiêu loại phân tử H2O cấu tạo từ các đồng vị trên?
A. 8. B. 6. C. 12. D. 18.
53. Trong tự nhiên Cu có hai đồng vị:  . Khối lượng nguyên tử trung bình của Cu là 63,54. Thành phần phần trăm về khối lượng của
. Khối lượng nguyên tử trung bình của Cu là 63,54. Thành phần phần trăm về khối lượng của  trong CuCl2 là giá trị nào dưới đây? Biết MCl= 35,5.
trong CuCl2 là giá trị nào dưới đây? Biết MCl= 35,5.
A. 73,0% B. 27,0% C. 32,33%. D. 34,18%.
54. Nguyên tử khối trung bình của clo là 35,5. Clo có hai đồng vị là 35Cl, 37Cl. % về khối lượng của 37Cl trong KClO3 là( cho 39K, 16O)
A. 24,90%. B. 21,65%. C. 28,98%. D. 7,55%.
55. Kí hiệu mức năng lượng của obitan nguyên tử nào sau đây là không đúng?
A. 3p. B. 4s. C. 2d. D. 3d.
56. Phát biểu nào dưới đây về cấu tạo vỏ nguyên tử là không đúng?
A. Lớp thứ n có n phân lớp. B. Lớp thứ n có  obitan.
obitan.
C. Lớp thứ n có 2n2 electron. D. Số obitan trong một phân lớp là số lẻ.
57. Số electron tối đa ở mỗi lớp electron được tính theo công thức (n: là số thứ tự lớp)
A. 2n. B. n2. C. n3. D. 2n2.
58. Trật tự các mức năng lượng obitan nguyên tử tăng dần theo trình tự:
A. 1s 2s 2p 3s 3p 3d 4s 4p 4d 5s 5p. B. 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p.
C. 1s 2s 2p 3s 3p 4s 3d 4p 4d 5s 5p. D. 1s 2s 2p 3s 3p 3d 4s 4p 5s 4d 5p.
59. Dãy nào trong các dãy sau đây gồm các phân lớp electron đã bão hoà?
A. s1, p3, d7, f12. B. s2, p5, d9, f13. C. s2, p4,d10, f11. D.s2, p6, d10, f14.
60. Nguyên tử của nguyên tố nào sau đây ở trạng thái cơ bản có số electron độc thân nhiều nhất
A. 27Co. B. 28Ni. C. 6C. D. 29Cu.
61. Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 7 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là:
A. 6. B. 14. C. 8. D. 17.
62. Nguyên tử A có Z = 13, số lượng obitan nguyên tử của A là
A. 6. B. 7. C. 8. D. 9.
63. Nguyên tử 27X có cấu hình electron là 1s22s22p63s23p1. Hạt nhân nguyên tử X có:
A. 13 proton và 14 nơtron. B. 13 proton và 14 electron.
C. 14 proton và 13 nơtron. D. 14 proton và 14 electron.
64. Trong tự nhiên clo có hai đồng vị 37Cl (24,23%) còn lại là 35Cl. Tính % khối lượng của 37Cl trong HClO4 ( 1H, 16O)
A. 9,82%. B. 8,92%. C. 89,2%. D. 0,892%.
65. Nguyên tử Cr có Z = 24 , cấu hình e của Cr là
A. 1s22s22p63s23p6 3d4 4s2. B. 1s22s22p63s23p64s13d5.
C. 1s22s22p63s23p6 3d5 4s1. D. 1s22s22p63s23p64s23d4.
66. Số oxi hóa của Cu, Fe và S trong quặng CuFeS2 lần lượt là:
A. +2, +2 và -2. B. +1, +2 và -2. C. +1, +3 và-2. D. +1, +1 và -1.
67. Nguyên tử Cu có Z = 29 , cấu hình e của Cu là
A. 1s22s22p63s23p6 3d9 4s2. B. 1s22s22p63s23p64s23d9.
C. 1s22s22p63s23p6 3d10 4s1. D. 1s22s22p63s23p64s13d10.
68. Nguyên tử của nguyên tố S (Z =16) có số electron độc thân bằng:
A. 1. B. 2. C. 3. D. 4.
69. Cấu hình electron nào đây vi phạm qui tắc Pau-li?
A. 1s2. B. 1s22s1. C. 1s3. D. 1s22p2.
70. Cho cấu hình electron của các nguyên tố sau: A: 1s22s22p63s2 ; B: 1s22s22p6
C: 1s22s22p63s23p5 ; D: 1s22s22p63s23p1 ; G: 1s22s22p63s1. Các nguyên tố kim loại là
A. A, D, B. B. B, C, A. C. C, B, G. D. A, D, G.
71. Cho cấu hình electron của các nguyên tố sau: A: 1s22s22p63s2 ; B: 1s22s22p4
C: 1s22s22p63s23p5 ; D: 1s22s22p63s23p1 ; G: 1s22s22p3. Các nguyên tố phi kim là
A. A, D, C. B. B, D, G. C. C, B, G. D. A, D, G.
72. Cấu hình electron nào đây vi phạm qui tắc Hun?
B. 1s22s22px2. C. 1s22s22px12py1. D. 1s22s22px12py12pz1. A. 1s2.
73. Cấu hình electron 1s2 2s2 2p6 không thể là của:
A. F- (Z = 9) B. Ne (Z = 10). C. Na ( Z = 11). D. Mg2+ ( Z = 12).
74. Cho 6 nguyên tử với cấu hình phân mức năng lượng cao nhất là: 1s2, 3s2, 3p1, 3p2, 3p6, 4p4. Số nguyên tử kim loại, phi kim, khí hiếm trong số 6 nguyên tử trên lần lượt là:
A. 4, 1, 1. B. 3, 2, 1. C. 2, 2, 2. D. 2, 3, 1.
75. Trong số các cấu hình electron nguyên tử sau, cấu hình nào là của 24Cr3+?
A. 1s22s23p63s23p63d64s2. B. 1s22s22p63s23p63d54s1.
C. 1s22s22p63s23p63d84s2. D. 1s22s22p63s23p63d3.
76. Nguyên tố s gồm các nguển tố nhóm:
A. IA, IIA. B. IA, IIA, IIIA. C. IIA, IVA. D. IIA, IIIA.
77. Hai ion đơn nguyên tử X2+ và Y- đều có cấu hình electron của nguyên tử khí hiếm Ar ( Z = 18 ), suy ra hai nguyên tử X và Y lần lượt có điện tích hạt nhân là:
A. 20 và 17. B. 17 và 20. C. 16 và 19. D. 16 và 17.
78. Số electron độc thân tối đa có thể có của S ( Z = 16) là:
A. 1. B. 2. C. 4. D. 6.
79. Cấu hình electron của ion nào dưới đây giống khí hiếm?
A. Cu+. B. Fe2+ . C. K+. D. Cr3+.
80. Phân lớp 3d trong nguyên tử có số electron tối đa là:
A. 6. B. 18. C. 10. D. 14.
81. Các ion và nguyên tử: Ne, Na+, F- có điểm chung là:
A. có cùng số khối B. có cùng số electron
C. có cùng số proton D. có cùng số nơtron.
82. Cation X+ có cấu hình electron ở lớp vỏ ngoài cùng là 2s22p6. Cấu hình electron của phân lớp ngoài cùng của nguyên tử X là:
A. 3s1. B. 3s2. C. 3p1. D. 2p5.
83. Trong các cấu hình electron dưới đây, cấu hình nào không tuân theo nguyênlí Pauli?
A. 1s22s1. B. 1s22s22p5. C. 1s22s22p63s2. D. 1s22s22p73s2.
84. Cấu hình electron nào dưới đây không đúng?
C. 1s22s22 2py2pz. D. 1s22s22px2py2pz.
2py2pz. D. 1s22s22px2py2pz.
85. Dãy gồm các ion X+, Y- và nguyên tử Z đều có cấu hình là: 1s22s2p6
A. K+, Cl-, Ar. B. Li+, F-, Ne. C. Na+, Cl-, Ar. D. Na+, F-, Ne.
86. Ion nào dưới đây không có cấu hình electron của khí hiếm?
A. Na+. B. Fe2+ . C. Al3+ . D. Cl-.
87. Cho các nguyên tử sau: Na (Z=11); Ca (Z = 20); Cr (Z = 24); Cu (Z = 29). Dãy nguyên tử nào dưới đây có số electron ở lớp ngoài cùng bằng nhau?
A. Ca, Cr, Cu. B. Ca, Cr. C. Na, Cr, Cu. D. Ca, Cu.
88. Cho 3 gam hỗn hợp X gồm Na và một kim loại kiềm A tác dụng hết với nước sau phản ứng thu được dung dịch B và khí C. Để trung hòa dung dịch B người ta cần dùng 200 ml dung dịch HCl 1M. Kim loai kiềm A là
A. Li. B. K. C. Rb. D. Cs.
89. Nguyên tử của nguyên tố A có tổng số electron trong các phân lớp p là 7. Nguyên tử của nguyên tố B có tổng số hạt mang điện nhiều hơn tổng số hạt mang điện của A là 8. A và B lần lượt là:
A. Al và Br. B. Al và Cl. C. Mg và Cl. D. Si và Br.
90. Cation X3+ và anion Y2- đều có cấu hình electron ở phân lớp ngoài cùng là 2p6. Kí hiệu của các nguyên tố X và Y lần lượt là:
A. Al và O. B. B và O. C. Al và S. D. Fe và S.
91. Anion X2- có cấu hình electron là 1s22s22p6. Cấu hình electron của X là:
A. 1s22s2. B. 1s22s22p63s2. C. 1s22s22p4. D. 1s22s22p53s1.
92. Anion X2- có cấu hình electron lớp ngoài cùng là 3s23p6. Cấu hình electron nguyên tử của X là:
A. 1s22s22p63s23p1. B. 1s22s22p63s23p4.
C. 1s22s22p63s2. D. 1s22s22p63s23p64s2.
93. Ion nào dưới đây không có cấu hình electron của khí hiếm?
A. Na+. B. Mn2+. C. Al3+ . D. S2-.
94. Cation kim loại Mn+ có cấu hình electron lớp ngoài cùng là 2s22p6. Cấu hình electron lớp ngoài cùng của nguyên tử M là:
A. 3s1 hoặc 3s2 hoặc 3s23p1. B. 3s1 hoặc 2s22p5.
C. 2s22p5 hoặc 2s22p4. D. 2s22p4 hoặc 3s2.
95. Nhóm là tập hợp các nguyên tố mà nguyên tử của chúng có cùng:
A. số lớp electron. B. số phân lớp electron.
C. số electron ở lớp ngoài cùng. D. số electron hoá trị (trừ một số ngoại lệ).
96. Cation M+ có cấu hình electron là 1s22s22p63s23p6. Trong bảng tuần hoàn M thuộc:
A. chu kỳ 3, nhóm VIIA. B. chu kỳ 3, nhóm VIA.
C. chu kỳ 3, nhóm IA. D. chu kỳ 4, nhóm IA.
97. Cation X2+ có cấu hình electron là 1s22s22p6. Trong bảng tuần hoàn, nguyên tố X thuộc:
A. chu kỳ 2, nhóm VIIIA. B.chu kỳ 3, nhóm IIA.
C.chu kỳ 2, nhóm VIA. D. chu kỳ 2, nhóm IIA.
98. Nguyên tố R thuộc nhóm VIA trong bảng tuần hoàn. Trong hợp chất của R với hiđro ( không có thêm nguyên tố khác) có 5,882% hiđro về khối lượng. R là nguyên tố nào dưới đây?
A. Oxi (Z = 8). B. Lưu huỳnh (Z = 16). C. Crom (Z =24). D. Selen (Z = 34).
99. Hợp chất khí với hiđro của nguyên tố R có dạng RH4. Trong oxit cao nhất với oxi, R chiếm 46,67% khối lượng. R là nguyên tố nào dưới đây?
A. C. B. Si. C. Pb. D. Sn.
100. Hãy so sánh và sắp xếp theo trật tự tăng dần kích thước (bán kính) của các ion sau: O2-, Mg2+, Na+, F-
A. O2-, Mg2+, Na+, F-. B. Mg2+, O2-, Na+, F-
C. Mg2+, Na+, F-, O2-. D. O2-, F- , Mg2+, Na+.
101. Dãy nguyên tố nào dưới đây được xếp theo chiều giảm dần tính kim loại (từ trái qua phải)?
A. Li, Na, K, Rb. B. F, Cl, Br, I. C. O, S, Se, Te. D. Na, Mg, Al, Cl.
102. Dãy nguyên tố nào dưới đây được xếp theo chiều tăng dần tính phi kim (từ trái qua phải)?
A. Li, Na, K, Rb. B. F, Cl, Br, I. C. Na, Mg, Be, S, Cl. D. O, S, Se, Te.
103. Ba nguyên tố A (Z = 11), B (Z = 12), D (Z = 13) có hiđroxit tương ứng là X, Y, T. Chiều tăng dần tính bazơ của các hiđroxit này là:
A. X, Y, T. B. X, T, Y. C. T, X, Y. D. T, Y, X.
104. Mỗi chu kỳ lần lượt bắt đầu từ loại nguyên tố nào và kết thúc ở loại nguyên tố nào?
A. Kim loại kiềm và halogen. B. Kim loại kiềm thổ và khí hiếm.
C. Kim loại kiềm và khí hiếm. D. Kim loại kiềm thổ và halogen.
105. Số thứ tự của các nhóm B thường được xác định bằng:
A. Số electron độc thân. B. Số electron ghép đôi.
C. Số electron thuộc lớp ngoài cùng. D. Số electron của 2 phân lớp là (n-1)d và ns.
106. Bán kính nguyên tử của dãy nguyên tố nào dưới đây được sắp xếp theo chiều tăng dần từ trái sang phải?
A. Li, Na, Rb, K, Cs. B. B, C, N, O, F .
C. Mg2+, Na+, Ne, F-, O2-. D. S2-, Cl-, Ar, K+, Ca2+.
107. Hợp chất với hiđro của nguyên tố R (nhóm A) có công thức RH2, oxit bậc cao nhất của R chứa 60% oxi về khối lượng. R là:
A. Mg. B. Ca. C. S. D. Se.
108. Các chất trong dãy nào sau đây được xếp theo thứ tự tính axit tăng dần?
A. NaOH, Al(OH)3, Mg(OH)2, H2SiO3. B. H2SiO3, Al(OH)3, H3PO4, H2SO4.
C. Al(OH)3, H2SiO3 H3PO4,H2SO4. D. H2SiO3, Al(OH)3, Mg(OH)2, H2SO4.
109. Bốn nguyên tố A, B, C, D có số hiệu nguyên tử lần lượt là : 9, 17, 35, 53. Các nguyên tố trên được sắp xếp theo chiều tính phi kim tăng dần như sau:( hãy chọn đáp án đúng)
A. A, B, C, D. B. A, C, B, D. C. A, D, B, C. D. D, C, B, A.
110. Dãy kim loại được sắp xếp theo chiều tính kim loại giảm dần:( hãy chọn đáp án đúng)
A. Ca, Sr, Mn, Cr, Fe, Ag. B. Fe, Ca, Mn, Cr, Sr, Ag.
C. Sr, Ca, Cr, Mn, Fe, Ag. D. Ca, Mn, Sr, Cr, Fe, Ag.
111. Dãy gồm các phi kim được sắp xếp theo thứ tự tính phi kim giảm dần:( hãy chọn đáp án đúng)
A. Cl, F, S, O. B. F, Cl, O, S. C. F, O, Cl, S . D. F, Cl, S, O.
112. Cho 56 gam Fe tác dụng với dung dịch HCl dư. Dẫn khí sinh ra qua ống đựng 160 gam CuO nung nóng. Khối lượng chất rắn trong ống sau phản ứng là:
A. 64 gam. B. 144 gam. C. 80 gam. D. 165,6 gam.
113. Cặp chất nào sau đây có phản ứng với nhau mạnh nhất:
A. Ca và Cl2. B. K và Cl2. C. Al và Cl2. D. Na và Cl2.
114. Nguyên tử X có phân lớp electron ngoài cùng là 3p4. Hãy chỉ ra câu sai trong các câu sau khi nói về nguyên tử X:
A. Lớp ngoài cùng của nguyên tử X có 6 electron. B. Hạt nhân nguyên tử X có 16 proton.
C. Trong bản tuần hoàn X nằm ở chu kỳ 3. D. Trong bản tuần hoàn X nằm ở nhóm IVA.
115. Nguyên tố X có Z = 29, vị trí của nguyên tố X trong bảng tuần hoàn là vị trí nào sau đây?
A. chu kỳ 4 nhóm IB. B. Chu kỳ 3 nhóm IA.
C. chu kỳ 4 nhóm IA. D. Chu kỳ 3 nhóm IB.
116. Biết nguyên tố X thuộc chu kỳ 3 nhóm VI của bảng tuần hoàn. Cấu hình electron nguyên tử của X là:
A. 1s22s22p63s23d4. B. 1s22s22p63s23p4. C. 1s22s22p63s4. D. 1s22s22p63s2.
117. Nguyên tố M thuộc nhóm A. Trong phản ứng oxi hoá - khử, M tạo ion M3+ có 37 hạt gồn proton, nơtron, electron. Vị trí của nguyên tố M trong bảng tuần hoàn là vị trí nào sau đây:
A. chu kỳ 3 nhóm IVA. B. chu kỳ 4 nhóm IIIA.
C. chu kỳ 3 nhóm IIIA. D. Kết quả khác.
118. Cation R+ có cấu hình electron kết thúc ở phân lớp 3p6. Vậy R thuộc:
A. chu kỳ 2 nhóm VIA. B. Chu kỳ 3 nhóm IA.
C. chu kỳ 4 nhóm IA. D. Chu kỳ 4 nhóm VIA.
119. Để oxi hoá hoàn toàn một kim loại M thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. Hãy chọn một trong những cấu trả lời sau:
A. kim loại hoá trị I. B. Kim loại hoá trị IV. C. Mg. D. Ca.
120. Nguyên tố X có hoá trị cao nhất với oxi gấp 3 lần hoá trị trong hợp chất khí với hiđro. Gọi A là công thức hợp chất oxit cao nhất, B là công thức hợp chất khí với hiđro của X. Tỉ khối hơi của A đối với B là 2,353. Nguyên tố X là:
A. Si. B. S. C. P. D. N.
121. Nguyên tố có cấu hình electron như sau: 1s22s22p63s23p6. Những anion nào sau đây có cấu hình electron trên?
A. Cl-, S2-, P3-. B. Cl-, S2-, N3-. C. F-, S2-, P3-. D. A, B, C đều sai.
122. Xét các nguyên tố Cl, Al, Na, P, F. Dãy thứ tự tăng dần của bán kính nguyên tử nào sau đây đúng:
A. F < Cl < P < Al < Na. B. F < Cl < Na < Al.
C. F < Cl < Al < P < Na. D. Cl < F < P < Na < Al.
123. Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 6, 9, 17. Nếu sắp xếp các nguyên tố theo thứ tự tính phi kim tăng dần thì dãy sắp xếp nào sau đây là đúng?
A. Z < X < Y. B. X < Y < Z. C. X < Z < Y. D. Kết quả khác.
124. Cho các nguyên tố K, L, M, N có số hiệu nguyên tử lần lượt là 19, 11, 12, 13. Nếu sắp xếp các nguyên tố theo thứ tự tính kim loại tăng dần thì dãy sắp xếp nào sau đây là đúng:
A. N < K < M < L . B. N < M < K < L. C. N < M < L < K. D. Kết quả khác.
125. Cho 8,8g một hỗn hợp hai kim loại nằm ở hai chu kỳ liên tiếp nhau và thuộc nhóm IIIA, tác dụng với dung dịch HCl dư thì thu được 6,72 lít khí hiđro ở đktc. Hai kim loại đó là kim loại nào sau đây:
A. Al và In . B. Ga và In. C. In và Pb. D. Al và Ga.
126. Khi cho 0,6 gam một kim loại nhóm IIA tác dụng với nước tạo 0,336 lít khí hiđro (đktc). Kim loại đó là kim loại nào sau đây:
A. Mg. B. Ca. C. Ba. D. Sr.
127. Oxit cao nhất của một nguyên tố R có dạng R2O7. R cho hợp chất khí với hiđro chứa 2,74% hiđro theo khối lượng. R là nguyên tố nào sau đây:
A. brom. B. clo. C. iot. D. flo.
128. Cho 6,9 gam một kim loại X thuộc nhóm IA tác dụng với nước, cho toàn bộ khí thu được cho tác dụng với CuO đun nóng. Sau phản ứng thu được 9,6 gam đồng kim loại. X là kim loại nào sau đây:
A. Na. B. Li. C. K. D. Rb.
129. Hỗn hợp X gồm hai kim loại A, B ở hai chu kỳ liên tiếp của nhóm IIA. Lấy 0,88g X cho hoà tan hoàn toàn trong dung dịch HCl dư, thu được 0,672 lít H2 (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được m gam muối khan. Giá trị của m và tên 2 kim loại A và B là:
A. 2,95g; Be và Mg. B. 3,01g; Mg và Ca. C. 2,85g; Ca và Sr. D. Tất cả đều sai.
130. Nguyên tố R thuộc nhóm A. Trong oxit cao nhất R chiếm 40% khối lượng. Công thức oxit đó là:
A. SO3 B. SO2 C. CO2 D. CO.
131. Một nguyên tố R có hoá trị trong oxit bậc cao nhất bằng hoá trị trong hợp chất khí với hiđro, phân tử khối oxit này bằng 1,875 lần phân tử khối hợp chất khí với hiđro. R là nguyên tố nào sau đây:
A. C. B. Si. C. S. D. N.
132. Nguyên tố M, thuộc phân nhóm IIA, 6 gam M tác dụng hết với nước thu được 6,16 lít khí H2 đo ở 27,30C, 1atm, M là nguyên tố nào sau đây:
A. Be. B. Mg. C. Ca. D. Ba.
133. Cho 19,6 gam hai kim loại A, B ở hai chu kì liên tiếp thuộc nhóm IIIA tác dụng hết với HCl sinh ra 13,44 lít khí (đktc). Hai kim loại A, B lần lượt là:
A. B, Al. B, Al, Ga. C. Ga, In. D. In, Tl.
134. Trong một chu kỳ của bảng tuần hoàn khi đi từ trái sang phải thì:
A. Năng lượng ion hoá giảm dần. B. Bán kính nguyên tử giảm dần.
C. Độ âm điện giảm dần. D. Ái lực điện tử giảm dần.
135. Dãy nào sau đây được sắp xếp theo thứ tự tăng dần kích thước nguyên tử?
A. H < K < Li < As < Cs. B. H < Li < K < As < Cs.
C. H < Li < As < K < Cs. D. H < As > Li < K < Cs.
136. Một nguyên tố tạo hợp chất khí với hiđro có công thức RH3. Trong oxit bậc cao nhất của R, nguyên tố oxi chiếm 74,07% về khối lượng. Xác định nguyên tố đó:
A. nitơ. B. photpho. C. lưu huỳnh. D. cacbon.
137. Nguyên tử nào mà trong trạng thái cơ bản của nó có số electron độc thân lớn nhất?
A. S (Z = 16). B. P (Z = 15). C. Ge (Z = 32). D. Al (Z = 13).
138. Trong một chu kỳ, theo chiều điện tích hạt nhân nguyên tử tăng dần:
A. Tính kim loại của các nguyên tố tăng dần. B. Tính phi kim của các nguyên tố giảm dần.
C. Hoá trị cao nhất của nguyên tố đối với oxi tăng dần.
D. Hoá trị cao nhất của nguyên tố phi kim đối với hiđro là không đổi.
139. Trong một nhóm A, theo chiều điện tích hạt nhân tăng dần:
A. Tính bazơ của các oxit và hiđroxit giảm dần. B. Tính axit của các oxit và hiđroxit tăng dần.
C. Tính bazơ của các oxit và hiđroxit tăng dần. D. Tính axit của các oxit và hidroxit không đổi.
140. Nguyên tử của nguyên tố nào sau đây có độ âm điện lớn nhất?
A. I. B. Cl. C. F. D. Br.
141. Nguyên tử có năng lượng ion hoá I1 thấp nhất là nguyên tử có số hiệu:
A. 11. B. 13. C. 15. D. 17.
142. Trong bảng tuần hoàn, nguyên tử của những nguyên tố hoá học trong cùng một chu kỳ có cùng:
A. năng lượng ion hoá I1. B. Độ âm điện.
C. Cấu hình electron lớp ngoài cùng của nguyên tử. D. Số lớp electron.
143. Trong cùng một nhóm A, nếu số hiệu nguyên tử tăng dần thì độ âm điện thường:
A. tăng dần. B. giảm dần.
C. không thay đổi. D. vừa tăng vừa giảm.
144. Trong cùng một nhóm A, nếu bán kính nguyên tử tăng dần thì năng lượng ion hoá thứ nhất I1 thường:
A. tăng theo. B. giảm theo.
C. không đổi. D. vừa tăng vừa giảm.
145. Nhóm nguyên tố nào mà hợp chất oxit có hoá trị cao nhất tương ứng với công thức chung là X2O3?
A. nhóm IA. B. nhóm IIA. C. nhóm VA. D. nhóm IIIA.
146. Kim loại hoạt động mạnh nhất ở vị trí nào trong bảng tuần hoàn?
A. ở đầu nhóm IA . B. ở cuối nhóm IA.
C. ở đầu nhóm VIIA. D. ở cuói nhóm VIIA.
147. Nguyên tố nào là kim loại kiềm?
A. Natri (Na.) B. Nhôm (Al). C. Clo (Cl). D. Magie (Mg).
148. Trong chu kỳ 2 của bảng tuần hoàn, nguyên tử của nguyên tố nào có năng lượng ion hoá I1 cao nhất?
A. kim loại kiềm. B. kim loại kiềm thổ. C. halogen. D. khí hiếm.
149. Dãy các nguyên tố nào sắp xếp theo chiều tăng của độ âm điện?
A. O, S, Se, Te. B. Cl, S, P, Si. C. Na, Sn, N, O. D. C, Si, P, Se.
150. Tính chất nào của nguyên tố trong bảng tuần hoàn được mô tả đúng?
A. Trong một nhóm nguyên tố, từ trên xuống dưới thì kích thước nguyên tử giảm dần.
B. Từ Fr trong nhóm IA đến F trong nhóm VIIA, kích thước nguyên tử tăng dần.
C. Trong một chu kỳ, từ trái qua phải thì kích thước nguyên tử giảm dần.
D. Tất cả những nguyên tử trong cùng một nhóm đều có kích thước nguyên tử bằng nhau.
151. Trong những hợp chất bền, kim loại kiềm thổ (nhóm IIA) thường tồn tại dưới dạng:
A. Cation M+. B. Cation M2+. C. Nguyên tử M. D. Ion M2-.
152. Chất nào (nguyên tử, ion) có bán kính nhỏ nhất?
A. nguyên tử clo (Cl). B. nguyên tử iot (I). C. Anion clorua (Cl-). D. Anion iotua (I-).
153. Năng lượng ion hoá thứ nhất của nguyên tử các nguyên tố: B, Al, Ga, In, Tl được sắp xếp theo chiều
A. Tăng dần. B. Giảm dần.
C. Không đổi. D. Vừa tăng, vừa giảm.
154. Nguyên tử của nguyên tố nào có kích thước lớn nhất?
A. Nhôm. B. Photpho. C. Nitơ . D. natri.
155. Nguyên tố nào có tính kim loại yếu nhất?
A. Gemani (Ge). B. Thiếc (Sn). C. Rubiđi (Rb). D. Xesi (Cs).
156. Tất cả các nguyên tố sau đây có tính chất hoá học tượng tự photpho, trừ nguyên tố:
A. Nitơ (N). B. Asen (As). C. Atimon (stibi) (Sb) . D. Canxi (Ca).
157. Các nguyên tố P, Q, R trong cùng một chu kỳ. Oxit của P tan trong nước tạo ra dung dịch có pH nhỏ hơn 7. Oxit của Q tan trong nước tạo ra dung dịch có pH lớn hơn 7. Oxit của R tác dụng với dung dịch axit clohiđric và dung dịch natri hiđroxit. Trật tự sắp xếp các nguyên tố P, Q, R theo chiều điện tích hạt nhân tăng dần là:
A. P, Q, R . B. P, R, Q. C. Q, R, P. D. R, P, Q.
158. Câu nào sau đâu có nội dung đúng?
A. Tất cả các nguyên tố trong cùng một nhóm của bảng tuần hoàn đều có cùng số electron.
B. Các nguyên tố trong nhóm IA tác dụng với nước tạo ra dung dịch có tính axit.
C. Phân tử các nguyên tố nhóm VIIIA gồm hai nguyên tử.
D. Trong một chu kỳ, theo chiều điện tích hạt nhân tăng dần thì giá trị của độ âm điện tăng dần.
159. Dãy nguyên tử nào sau đây được xếp theo chiều bán kính nguyên tử tăng dần?
A. I, Br, Cl, P. B. C, N, O, F. C. Na, Mg, Al, Si. D. O, S, Se, Te.
160. Cho dãy các nguyên tố nhóm IIA: Mg - Ca - Sr - Ba. Từ Mg đến Ba, theo chiều điện tích hạt nhân tăng tính kim loại thay đổi theo chiều:
A. tăng dần. B. giảm dần. C. tăng rồi giảm. D. giảm rồi tăng.
161. Cho dãy các nguyên tố nhóm VA: N - P - As - Sb - Bi. Từ N đến Bi, theo chiều điện tích hạt nhân tăng, tính phi kim thay đổi theo chiều:
A. tăng dần. B. giảm dần. C. tăng rồi giảm. D. giảm rồi tăng.
162. Cho các nguyên tố Li, Na, K, Rb, Cs thuộc nhóm IA trong bảng tuần hoàn. Trong số các nguyên tố trên, nguyên tố có năng lượng ion hoá thứ nhất nhỏ nhất là:
A. Li (Z = 3). B. Na (Z = 11). C. Rb (Z = 37) . D. Cs (Z = 35).
163. Cho 6,4g hỗn hợp hai kim loại nhóm IIA, thuộc hai chu kỳ liên tiếp, tác dụng hết với dung dịch HCl dư thu được 4,48 lít khí hiđro (đktc). Các kim loại đó là:
A. Be và Mg B. Mg và Ca C. Ca và Sr. D. Sr và Ba.
164. Các nguyên tố nhóm A trong bảng tuần hoàn là:
A. các nguyên tố s . B. các nguyên tố p.
C. các nguyên tố s và các nguyên tố p. D. các nguyên tố d.
165. Nguyên tử của nguyên tố hoá học X có cấu hình electron lớp ngoài cùng là: (n-1)d5ns1 (trong đó n ≥4). Vị trí của X trong bảng tuần hoàn là:
A. chu kỳ 4, nhóm IB. B. chu kỳ n, nhóm IA.
C. chu kỳ n, nhóm VIB. D. chu kỳ n, nhóm VIA.
166. Hoà tan hoàn toàn 0,3 gam hỗn hợp hai kim loại X và Y ở hai chu kỳ liên tiếp của nhóm IA vào nước thì thu được 0,224 lít khí hiđro ở đktc. Hai kim loại X và Y lần lượt là:
A. Na và K. B. Li và Na. C. R và Rb. D. Rb và Cs.
167. Oxit cao nhất của một nguyên tố có công thức tổng quát là R2O5, hợp chất của nó với hiđro có thành phần khối lượng: %R = 82,35%; %H = 17,65%. Nguyên tố R là:
A. photpho. B. nitơ. C. asen . D. antimoan.
168. Hợp chất khí với hiđro của một nguyên tố có công thức tổng quát là RH4, oxit cao nhất của nguyên tố này chứa 53,(3)% oxi về khối lượng. Nguyên tố đó là:
A. cacbon. B. chì. C. thiếc. D. silic.
169. Hoà tan hoàn toàn 10,00 gam hỗn hợp hai kim loại đều đứng trước hiđro trong dãy hoạt động hóa học trong dung dịch HCl dư thấy tạo ra 2,24 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng thu được m gam muối khan, giá trị của m là:
A. 15,10 gam. B. 16,10 gam. C. 17,10 gam. D. 18,10 gam.
170. Hoà tan 9,14 gam hợp kim Cu, Mg, Al bằng một lượng vừa đủ dung dịch HCl thu được 7,84 lít khí X (đktc) và 2,54g chất rắn Y và dung dịch Z. Cô cạn dung dịch Z thu được m gam muối khan. Vậy m có giá trị là:
A. 34,15 gam. B. 35,14 gam. C. 31,45 gam. D. 32,45 gam.
171. Các nguyên tử của phân tử nào cho dưới đây đều đã đạt cấu hình bền của khí hiếm gần kề?
A. BeH2. B. AlCl3. C. SiH4. D. PCl5.
172. Cho biết kết luận về trạng thái lai hoá của nguyên tử trung tâm nào dưới đây là đúng?
A. C trong CO2 lai hoá sp2. B. N trong NH3 lai hoá sp3.
C. S trong SO2 lai hoá sp3. D. O trong H2O lai hoá sp.
173. Trong các phân tử dưới đây, phân tử nào có cấu tạo hình học dạng tháp đáy tam giác?
A. BH3. B. PH3. C. SO3. D. AlCl3.
174. Trạng thái lai hóa của nguyên tử trung tâm nào dưới đây không đúng?
A. C trong CO2 là sp2. B. O trong H2O là sp3.
C. N trong NH3 là sp3. D. Be trong BeH2 là sp.
175. Dãy nào dưới đây các chất được xác định cấu trúc tinh thể hoàn toàn đúng?
A. Tinh thể kim cương, lưu huỳnh, photpho và magie thuộc loại tinh thể nguyên tử.
B. Tinh thể muối ăn , xút ăn da ( NaOH), potat (KOH), và diêm tiêu (KNO3) thuộc loại tinh thể ion.
C. Tinh thể natri, sắt, đồng, nhôm, vàng và than chì thuộc loại tinh thể kim loại.
D. Tinh thể nước đá, đá khô (CO2), iôt và muối ăn thuộc loại tinh thể phân tử.
176. Phát biểu nào dưới đây là không đúng?
A. Tinh thể kim loại có ánh kim, có tính dẻo, có khả năng dẫn điện và dẫn nhiệt.
B. Tinh thể phân tử mềm, xốp, có nhiệt độ thấp và dễ bay hơi.
C. Liên kết trong tinh thể nguyên tử là tương tác vật lí kém bền.
D. Liên kết trong tinh thể ion là liên kết ion bền.
177. Liên kết hoá học trong phân tử CS2 là:
A. Liên kết ion. B. Liên kết cộng hoá trị.
C. Liên kết cho nhận (phối trí). D. Vừa liên kết ion, vừa liên kết cộng hoá trị.
178. Trong phân tử N2 có:
A. 3 liên kết p. B. 2 liên kết s và một liên kết p .
C. 1 liên kết s và 2 liên kết p. D. 3 liên kết s .
179. Trong các loại tinh thể, tinh thể nào dẫn điện và dẫn nhiệt ở điều kiện thường:
A. Tinh thể phân tử. B. Tinh thể nguyên tử.
C. Tinh thể ion. D. Tinh thể kim loại.
180. Liên kết trong kim loại được đặc trưng bởi:
A. Sự chuyển động tự do của các electron trong toàn mạng lưới tinh thể.
B. Sự tồn tại mạng lưới tinh thể kim loại.
C. Tính có ánh kim mạnh. D. Tính dẫn điện và dẫn nhiệt tốt.
181. Có bao nhiêu electron trong ion  :
:
A. 60. B. 28. C. 20. D. 32.
182. Những ion nào sau đây có cấu hình electron lớp ngoài cùng là: 3s23p6
A. Cl-, S2-, Na+, K+. B. Cl-, S2-, K+, Ca2+.
C. Br-, I-, Cl-, F-. D. Ar, Cl-, K+, Al3+.
183. Có bao nhiêu electron trong ion  :
:
A. 102. B. 104. C. 106. D. 232.
184. Những chất nào dưới đây có mạng tinh thể nguyên tử:
A. Iot, kim cương, photpho trắng, đồng. B. Đồng.
C. Kim cương. D. Muối ăn.
185. Những chất nào dưới đây có mạng tinh thể phân tử:
A. Naptalen, iot, CO2, photpho trắng, nước đá. B. Naptalen, iot.
C. Naptalen, iot, CO2, nước đá. D. Naptalen, CO2, nước đá.
186. Những chất nào dưới đây có mạng tinh thể ion:
A. Chỉ có naptalen. B. Chỉ có muối ăn.
C. Nước đá. D. Chỉ có kim cương.
187. Cho các phân tử sau đây: NaCl, KCl, RbCl, CsCl. Hãy cho biết liên kết trong phân tử nào mang tính chất ion nhất?
A. NaCl. B. KCl. C. RbCl. D. CsCl.
188. Trong phân tử CH4 nguyên tử trung tâm có lai hoá kiểu:
A. sp. B. sp2. C. sp3. D. sp3d.
189. Dãy gồm các phân tử có cùng một kiểu liên kết:
A. Cl2, Br2, I2, HCl. B. Na2O, KCl, BaCl2, Al2O3.
C. HCl, H2S, NaCl, N2O D. MgO, H2SO4, H3PO4, HCl
190. Dãy chất được sắp xếp theo chiều tăng dần sự phân cực liên kết trong phân tử:
A. HCl, Cl2, NaCl. B. Cl2, HCl, NaCl.
C. NaCl, Cl2, HCl. D. Cl2, NaCl, HCl.
191. Số oxi hoá của nitơ trong NH4+ là
A. -4. B. -3. C. +3. D. +5.
192. Số oxi hoá của nitơ, lưu huỳnh, cacbon, oxi trong HNO3, FeS2, HCOOH, H2O2 lần lượt là
A. +5, -1, +2, -2. B. +5, -2, 0, -2. C. +5, -1, +2, -1. D. +5, -1, 0, -2.
193. Số oxi hoá của nguyên tử C trong CO2, H2CO3, HCOOH, CH4 lần lượt là:
A. -4, +4, +3, +4. B. +4, +4, +2, +4. C. +4, +4, +2, -4. D. +4, -4, +3, +4.
194. Điều khẳng định nào sau về mạng tinh thể nguyên tử là đúng?
A. Liên kết trong mạng là liên kết giữa các phân tử rất yếu. (Liên kết Van-đec-van).
B. Chất có cấu tạo mạng tinh thể nguyên tử có nhiệt độ nóng chảy cao.
C. Chất có cấu tạo mạng tinh thể nguyên tử có độ cứng nhỏ.
D. Chất có cấu tạo mạng tinh thể nguyên tử dễ bay hơi.
195. Dựa vào độ âm điện của các nguyên tố trong bảng hệ thống tuần hoàn hãy cho biết trong số các phân tử sau phân tử nào phân cực nhất: CaO, CO2, BCl3, NH3.
A. CaO. B. CO2. C. BCl3. D. NH3.
196. Trong số các phân tử sau: HCl, NaCl, CaCl2, AlCl3. Phân tử nào mang liên kết ion rõ rệt nhất?
A. HCl. B. NaCl. C. CaCl2. D. AlCl3.
197. Cho các hợp chất ion sau: CaO(1), CuCl2 (2), Ca(OH)2 (3), NaClO3 (4), H2S (5),  (6), Na2SO3 (7). Trong các phân tử hoặc ion đó thì phân tử hoặc ion có liên kết ion là:
(6), Na2SO3 (7). Trong các phân tử hoặc ion đó thì phân tử hoặc ion có liên kết ion là:
A. 1, 2, 3, 5, 6. B. 1, 2, 3, 4, 7. C. 1, 3, 4, 5, 7. D. 1, 3, 4 và 7.
198. Cho các hợp chất hoặc ion sau: NH3 (1), CO (2), OCl- (3),  (4), HCN (5), MgO (6), Al2O3 (7), Cu(OH)2 (8). Các phân tử, ion có liên kết cộng hoá trị là:
(4), HCN (5), MgO (6), Al2O3 (7), Cu(OH)2 (8). Các phân tử, ion có liên kết cộng hoá trị là:
A. 1, 2, 5, 8. B. 1, 2, 3, 5, 8.
C. 2, 3, 4, 5. D. 1, 2, 3, 4, 5 và 8.
199. Cho các phân tử sau: C2H2 (1), BF3 (2), BeCl2 (3), C2H4 (4), CH4 (5), Cl2 (6), H2 (7), H2O (8), NH3 (9), HCl (10). Trong các phân tử trên sự hình thành liên kết trong các phân tử nhờ:
a, sự lai hoá sp các AO hóa trị là:
A. 1, 3, 6. B. 1, 2, 3, 5. C. 1, 3, 4, 7. D. 1, 3.
b, Sự lai hoá sp2 các AO hoá trị là:
A. 2, 4 B. 2, 6. C. 2, 3, 4. D. 2, 3.
c, Sự lai hoá sp3 các AO hoá trị là:
A. 5, 6, 8, 10. B. 5, 8, 9. C. 3, 5, 8, 9. D. 5, 6, 8, 9.
200. Trong ion X2+ có:
A. Số e – số p = 2. B. Số p – số e = 2. C. Số n – số p = 2. D. Số n – số e = 2.
201. Cho các phân tử và ion sau:  (1), NH3 (2), BF3 (3), SO2 (4), C2H2 (5), NF3 (6). Trạng thái lai hoá của các nguyên tử trung tâm trong các phân tử và ion trên:
(1), NH3 (2), BF3 (3), SO2 (4), C2H2 (5), NF3 (6). Trạng thái lai hoá của các nguyên tử trung tâm trong các phân tử và ion trên:
a, Lai hoá sp2 là:
A. 3, 4, 5. B. 3, 4. C. 4, 5, 6. D. 1, 2, 3.
b, Lai hoá sp3 là:
A. 1, 2, 6. B. 1, 2, 5. C. 2, 3, 6. D. 1, 2, 3.
c, Lai hoá sp là:
A. 3. B. 4. C. 5. D. 6.
202. Trong phân tử nitơ có:
A. 1 liên kết đôi. B. 1 liên kết σ và 2 liên kết π.
C. 1 liên kết cộng hoá trị phân cực. D. 1 liên kết π và 2 liên kết σ.
203. Cho các ion sau:  (1),
(1),  (2),
(2),  (3),
(3),  (4),
(4),  (5),
(5),  (6). Trong các ion trên, liên kết cho nhận có trong các ion sau là:
(6). Trong các ion trên, liên kết cho nhận có trong các ion sau là:
A. 1, 2, 3, 5. B. 1, 3, 4, 5. C. 1, 2, 4, 5. D. 1,2,3,4,5.
204. Trong ion X2- có:
A. Số e – số p = 2. B. Số p – số e = 2. C. Số n – số p = 2. D. Số n – số e = 2.
205. Kết luận nào sau đây sai?
A. Liên kết trong phân tử NH3, H2O là liên kết cộng hoá trị phân cực.
B. Liên kết trong phân tử BaF2 và CsCl là liên kết ion.
C. Liên kết trong phân tử CaS và AlCl3 là liên kết ion vì được hình thành giữa kim loại và phi kim.
D. Liên kết trong phân tử Cl2, H2, O2, N2 là liên kết cộng hoá trị không cực.
206. Cho các chất sau: CaCl2, K2S, CaS, Al2S3, AlCl3, KF. Liên kết cộng hoá trị phân cực có trong các chất nào sau đây?
A. CaCl2, K2S, CaS, Al2S3. B. K2S, CaS, Al2S3, KF.
C. CaCl2, CaS, Al2S3, AlCl3, KF. D. CaS, Al2S3, AlCl3.
207. Cho dãy oxit sau: K2O, CaO, Al2O3, SiO2, SO3, Cl2O7, P2O5, trong các oxit trên, liên kết trong phân tử oxit nào thuộc liên kết cộng hoá trị?
A. SiO2, SO3, P2O5, Cl2O7. B. SiO2, SO3, P2O5, K2O.
C. SiO2, SO3, P2O5, Al2O3. D. SO3, P2O5, SiO2, CaO.
208. Cho phân tử các chất: CH4, CaO, MgO, AlN, NaBr, BCl3, AlCl3. Chiều tăng dần độ phân cực liên kết của các nguyên tố trong các chất trên là dãy nào sau đây:
A. CH4, BCl3, AlN, AlCl3, NaBr, MgO, CaO. B. CH4, AlN, AlCl3, BCl3, NaBr, CaO, MgO.
C. CH4, BCl3, AlCl3, AlN, NaBr, MgO, CaO. D. Tất cả đều sai.
209. Dãy nào trong các dãy hợp chất dưới đây chứa các hợp chất có độ phân cực của liên kết tăng dần:
A. CO2, SiO2, ZnO, CaO. B. CaCl2, ZnSO4, CuCl2, Na2O.
C. FeCl2, CaCl2, NiCl, MgCl2. D. NaBr, KBr, NaCl, LiF.
210. Cặp chất nào sau đây mỗi chất trong cặp chứa cả 3 loại liên kết (ion, cộng hoá trị, cho nhận):
A. NaCl và H2O. B. NH4Cl và Al2O3.
C. K2SO4 và KNO3. D. Na2SO4 và Ba(OH)2.
211. Cho các phân tử sau: LiCl, NaCl, KCl, RbCl, CsCl. Trong các phân tử này, liên kết trong phân tử mang nhiều tính chất ion nhất?
A. LiCl và NaCl. B. KCl. C. RbCl. D. CsCl.
212. Cho phân tử các chất sau: NH3, H2S, H2O, H2Se, CsCl, CaS, BaF2 (độ âm điện Cs = 0,79, Cl = 3,16, Se = 2,55, H = 2,2, S = 2,58, N = 3,04, O = 3,44, Ba = 0,89, Ca = 1, F = 3,98). Chiều tăng dần độ phân cực liên kết trong các oxit của các nguyên tố là dãy nào sau đây:
A. H2Te, H2S, NH3, CsCl, NH3, CaS, BaF2. B. H2Te, H2S, H2O, NH3, CsCl, CaS, BaF2.
C. H2Te, H2S, NH3, H2O, CaS, CsCl, BaF2. D. H2Te, H2S, H2O, NH3, CaS, CsCl, BaF2.
213. Cho các ion sau:  . Số electron trong mỗi ion trên lần lượt là:
. Số electron trong mỗi ion trên lần lượt là:
A. 32, 50, 32, 36, 10. B. 32, 42, 32, 36, 9.
C. 32, 50, 32, 35, 10. C. 32, 36, 32, 35, 10.
214. Khi tạo thành liên kết ion, nguyên tử nhường electron hoá trị để trở thành:
A. Ion dương có nhiều proton hơn. B. Ion dương có số proton không thay đổi.
C. Ion âm có nhiều proton hơn. D. Ion âm có số proton không thay đổi.
215. Hợp chất nào thể hiện đặc tính liên kết ion rõ nhất?
A. CCl4 B. MgCl2 C. H2O. D. CO2.
216. Kiểu mạng tinh thể nào thường có nhiệt độ nóng chảy thấp nhất?
A. Mạng tinh thể phân tử. B. Mạng tinh thể nguyên tử.
C. Mạng tinh thể ion. D. Mạng tinh thể kim loại.
217. Những nguyên tử cacbon trong kim cương hoặc than chì liên kết với nhau bằng:
A. Liên kết kim loại. B. Liên kết ion.
C. Liên kết cộng hoá trị không cực. D. Liên kết cộng hoá trị có cực.
218. Ion nào có tổng số proton bằng 48?
219. Phân tử chất nào có liên kết cộng hoá trị không phân cực rõ nhất?
A. SO2. B. F2. C. CS2. D. PCl3.
220. Phân tử nào có sự lai hoá sp2?
A. BF3. B. BeF2. C. NH3. D. CH4.
221. Những ion có cùng số electron sau đây, ion nào có bán kính nhỏ nhất?
A. S2- B. Ca2+. C. K+. D. Cl-.
222. Kim cương có kiểu cấu tạo mạng tinh thể nào?
A. Mạng tinh thể ion. B. Mạng tinh thể kim loại.
C. Mạng tinh thể nguyên tử. D. Mạng tinh thể phân tử.
223. Nguyên tố nào có thể có số oxi hoá cao nhất?
A. Al. B. C. C. Cl. D. N.
224. Khi phản ứng hoá học xảy ra giữa những nguyên tử có cấu hình electron ở trạng thái cơ bản là 1s22s1 và 1s22s22p5 thì liên kết này là:
A. Liên kết cộng hoá trị có cực. B. Liên kết cộng hoá trị không cực.
C. Liên kết ion. D. Liên kết kim loại.
225. Công thức hóa học nào của antimon (V) oxit được viết đúng?
A. SbO5. B. Sb5O. C. Sb2O5. D. Sb5O2.
226. Liên kết hóa học trong hợp chất nào mang đặc tính ion rõ hơn?
A. K2S B. HCl C. Cl2. D. H2O.
227. Liên kết hoá học nào được hình thành do sự di chuyển những electron lớp ngoài cùng của nguyên tử để tạo thành cặp electron liên kết là kiểu:
A. Liên kết ion B. Liên kết cộng hóa trị.
C. Liên kết kim loại D. Liên kết hiđro.
228. Nguyên tử magie có số hiệu nguyên tử là 12, tạo ra ion Mg2+. Cấu hình electron của ion Mg2+ là:
A. 1s22s22p63s1. B. 1s22s22p63s23p6. C.1s22s22p6. D. 1s22s22p63s2.
229. Dãy nào sau đây không chứa hợp chất ion?
A. NH4Cl, OF2, H2S. B. CO2, Cl2, CCl4.
C. BF3, AlF3, CH4. D. I2, CaO, CaCl2.
230. Cho các nguyên tố M (Z = 11), R (Z = 19) và X (Z = 3). Khả năng tạo ion từ các nguyên tử tăng dần theo thứ tự nào sau đây:
A. M < R < X. B. X < R < M. C. X < M < R. D. M < X < R.
231. Cho các nguyên tố M (Z = 11), R (Z = 19) và X (Z = 3). Các ion được tạo ra từ các nguyên tử các nguyên tố trên là:
A. M+,R+, X2+. B. M+,R+, X+. C. M2+,R+, X2+. D. M+,R2+, X2+.
232. Cho các nguyên tố R (Z = 8), X (Z = 9) và Z (Z = 16). Khả năng tạo ion từ các nguyên tử tăng dần theo thứ tự nào sau đây?
A. Z < R < X. B. X < R < Z. C. X < Z < R. D. Z < X < R.
233. Cho các nguyên tố R (Z = 8), X (Z = 9) và Z (Z = 16). Các ion được tạo ra từ nguyên tử các nguyên tố trên là:
A. Z2-, R3-, X2-. B. Z+, R2-, X+. C. Z2-, R-, X2-. D. Z2-, R2-, X-.
234. Kiểu lai hoá đường thẳng là:
A. Lai hoá sp3. C. lai hoá sp2. D. lai hoá dsp3. B. lai hoá sp.
235. Kiểu lai hoá tứ diện là:
A. lai hoá sp3d2. C. lai hoá sp3. D. lai hoá sp2. B. lai hoá sp.
236. Kiểu lai hoá tam giác là:
A. lai hoá sp3. C. lai hoá sp2. D. lai hoá d2sp3. B. lai hoá sp.
237. Phân tử nước có dạng góc với góc HOH bằng 1050 chứng tỏ:
A. nguyên tử oxi ở trạng thái lai hoá sp3. B. nguyên tử oxi ở trạng thái cơ bản.
D. cả ng/tử oxi và hiđro đều ở trạng thái lai hoá sp3. C. nguyên tử hiđro ở trạng thái lai hoá sp3.
238. Liên kết hoá học trong phân tử NH3 thuộc loại:
A. liên kết cộng hoá trị không phân cực. D. liên kết ion.
B. liên kết cộng hoá trị phân cực từ phía nguyên tử nitơ sang phía nguyên tử hiđro.
C. liên kết cộng hoá trị phân cực từ phía nguyên tử hiđro sang phía nguyên tử nitơ.
239. Liên kết hóa học tạo giữa hai nguyên tử của hai nguyên tố phi kim khác nhau thuộc loại:
A. Liên kết cộng hoá trị phân cực. B. Liên kết cộng hoá trị không phân cực.
C. Liên kết ion. D. Liên kết ion hoặc liên kết cộng hóa trị.
240. Liên kết hóa học trong phân tử CH4 được hình thành giữa nguyên tử C và các nguyên tử hiđro bằng sự xen phủ của:
A. các obitan s của nguyên tử hiđro với các obitan s và p của nguyên tử cacbon.
B. các obitan s của nguyên tử hiđro với các obitan sp3 của nguyên tử cacbon.
C. các obitan lai hoá của nguyên tử hiđro với các obitan s và p của cacbon.
D. các obitan lai hoá của nguyên tử H với các obitan lai hoá sp3 của ngưyên tử cacbon.
241. Liên kết xichma là liên kết hoá học:
A. bền hơn liên kết pi. B. kém bền hơn liên kết pi.
C. hình thành nhờ sự xen phủ bên giữa các obitan.
D. hình thành bởi tương tác tĩnh điện giữa các ng/tử.
242. Cho các nguyên tố: X (Z = 15), Y (Z = 17). Liên kết hoá học giữa X và Y thuộc loại:
A. Liên kết cộng hoá trị phân cực. B. Liên kết ion.
C. Liên kết cộng hoá trị không phân cực. D. Liên kết cộng hoá trị.
243. Cho các nguyên tố: natri (Z = 11), clo (Z = 17) và lưu huỳnh (Z = 16). Liên kết hóa học giữa lưu huỳnh và clo thuộc loại:
A. Liên kết cho- nhận. B. Liên kết ion.
C. Liên kết cộng hoá trị không phân cực. D. Liên kết cộng hoá trị phân cực.
244. Cho các nguyên tố: natri (Z = 11), clo (Z = 17) và lưu huỳnh (Z = 16). Trong hợp chất NaCl và Na2S, clo và lưu huỳnh có số oxi hoá lần lượt bằng:
A. -1 và -2. B. +1 và +2. C. +1 và -2. D. -1 và +2.
245. Liên kết kim loại là liên kết được hình thành:
A. bởi các cặp electron dùng chung giữa hai nguyên tử.
B. giữa các nguyên tử và ion trong mạng tinh thể có sự tham gia của các electron tự do.
C. nhờ lực hút tĩnh điện giữa các ion mang điện trái dấu.D. bằng cách góp chung các electron hoá trị.
246. Trong phân tử, các chất trong dãy chất nào sau đây chỉ có các liên kết cộng hoá trị phân cực?
A. N2, HCl, CO, O2. B. HCl, NaCl, ClO2, SO3.
C. HCN, COS, SOCl2, CH4. D. NO, NaH, HCN, SO2.
247. Dựa vào giá trị độ âm điện của các nguyên tố (xem SGK), hãy tính toán để xác định câu phát biểu đúng trong các câu sau đây
1, Độ phân cực của các liên kết trong các phân tử tăng dần theo dãy:
A. SO2, H2O, H2S, Na2O. B. H2S, SO2, H2O, Na2O.
C. SO2, H2S, H2O, Na2O. D. H2S, Na2O, SO2, H2O.
2, Trong các hợp chất Na2S và Na2O, các nguyên tố oxi và lưu huỳnh đều có điện hoá trị bằng:
A. -2. B. 2-. C. 2. D. II.
3, Trong các hợp chất H2S và H2O, các nguyên tố oxi và lưu huỳnh đều có cộng hoá trị bằng:
A. -2. B. 2-. C. 2. D. II.
248. Trong phân tử H3N, nguyên tử nitơ ở trạng thái lai hoá sp3. Phân tử H3N có dạng:
A. tam giác phẳng. B. đường thẳng. D. vuông phẳng. C. tứ diện.
249. Cho các chất sau: HCl, HClO, HClO3, NaClO, NaClO4. Số oxi hoá của clo trong các chất lần lượt bằng:
A. -1, +1, +5, +1, +7. B. -1, +1, +3, +1, +5. C. -1, -1, +5, +1, +7. D. -1, +1, +7, +1, +5.
250. Hãy chọn câu sai trong các câu sau:
A. Trong phản ứng phân huỷ, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
B. Trong phản ứng hóa hợp, số oxi hoá của các nguyên tố không thay đổi.
C. Trong phản ứng thế, bao giờ cũng có sự thay đổi số oxi hoá của các nguyên tố.
D. Trong phản ứng trao đổi, số oxi hoá của các nguyên tố không thay đổi.
251. Có phương trình hoá học: K2CO3 + 2HCl → 2KCl + CO2↑ + H2O. Phương trình hoá học trên thuộc loại phản ứng:
A. Oxi hoá khử. B. Trao đổi. C. Phản ứng thế. D. Phản ứng cộng.
252. Hãy chọn câu đúng trong các câu sau:
A. Chất khử là chất có số oxi hoá giảm. B. Chất oxi hoá là chất có số oxi hoá giảm.
C. Sự oxi hoá ứng với sự giảm số oxi hoá của một nguyên tố.
D. Sự khử ứng với sự tăng số oxi hoá của một nguyên tố.
253. Hãy chọn câu đúng trong các câu sau:
A. Hợp chất giàu oxi dùng để điều chế oxi.
B. Phản ứng phân huỷ là phản ứng để điều chế oxi trong phòng thí nghiệm.
C. Thu khí oxi qua nước vì khí oxi ít tan trong nước.
D. Thu khí oxi bằng cách đẩy không khí ra khỏi lọ.
254. Phát biểu nào sau đây sai:
A. Sự oxi hoá là sự làm tăng số oxi hoá của một nguyên tố.
B. Sự khử là sự làm giảm số oxi hoá của một nguyên tố.
C. Số oxi hoá của một nguyên tố chính là hoá trị của nguyên tố đó.
255. Những chất trong dãy nào có cùng số oxi hoá?
A. Đồng trong Cu2O và CuO. B. Sắt trong FeO và Fe2O3.
C. Mangan trong MnO2 và KMnO4. D. Lưu huỳnh trong SO3 và H2SO4.
256. Một trong những phương trình hoá học nào có số oxi hoá của clo tăng một đơn vị?
A. Cl2 (k) + H2 (k) → 2HCl (k).
B. NaCl (dd) + AgNO3 (dd) → AgCl (r) + NaNO3 (dd).
C. MnO2 (r) + 4HCl → (dd) MnCl2 (dd) + 2H2O + Cl2 (k)
D. 2KClO3 (r) → 2KCl (r) + 3O2 (k).
257. Sự oxi hoá là:
A. Sự kết hợp của một chất với hiđro. B. Sự làm giảm số oxi hoá của một chất.
C. Sự làm tăng số oxi hoá của một chất. D. Sự nhận electron của một chất.
258. Sự khử là:
A. Sự kết hợp của một chất với oxi. B. Sự nhận electron của một chất.
C. Sự tách hiđro của một hợp chất. D. Sự làm tăng số oxi hoá của một chất.
259. Số oxi hoá của N được sắp xếp theo thứ tự tăng dần như sau:
A.  < N2 < N2O < NO <
< N2 < N2O < NO <  < NO2 <
< NO2 <  . B. NO < N2O < NH3 <
. B. NO < N2O < NH3 <  < HNO3.
< HNO3.
C. NH3 < N2 <  < NO <
< NO <  . D. NH3 < NO < N2O < NO2 < N2O5.
. D. NH3 < NO < N2O < NO2 < N2O5.
260. Biết công thức hoá học của một hợp chất ta có thể biết được những thông tin sau, trừ:
A. Số oxi hoá của các nguyên tố. C. Số mol phân tử của hợp chất.
B. Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất.
D.Thành phần % theo khối lượng của mỗi nguyên tố trong hợp chất.
261. Sự mô tả nào về tính chất của bạc trong phản ứng sau là đúng?
AgNO3(dd) + NaCl (dd) → AgCl (r) + NaNO3(dd).
A. Nguyên tố bạc bị oxi hoá. B. Nguyên tố bạc bị khử.
C. Nguyên tố bạc không bị oxi hoá cũng không bị khử. D. Nguyên tố bạc vừa bị oxi hoá vừa bị khử.
262. Trong phản ứng: Zn(r) + CuCl2 (dd) → ZnCl2 (dd) + Cu (r). Cu2+ trong CuCl2 đã:
A. bị oxi hoá. B. bị khử.
C. Không bị oxi hoá và không bị khử. D. Bị oxi hoá và bị khử.
263. Trong phản ứng: Cl2 (r) + 2KBr → (dd) Br2 (l) + 2KCl (dd). Clo đã:
A. Bị oxi hoá. B. bị khử.
C. Không bị oxi hoá và không bị khử. D. Bị oxi hoá và bị khử.
264. Trong phản ứng: Zn (r) + Pb2+ (dd) → Zn2+ (dd) + Pb (r). Ion Pb2+ đã:
A. Cho 2 electron. B. Nhận 2 electron. C. Cho 1 electron. D. Nhận 1 electron.
265. Chất oxi hoá trong phản ứng giữa kim loại kali với phi kim clo là:
A. Cl-. B. Cl2 . C. K. D. K+.
267. Trong phản ứng: 2NaCl + 3SO3 → Cl2 + SO2 + Na2S2O7. Số oxi hoá của lưu huỳnh trong SO3 và SO2:
A. +2 và 0 . B. +6 và +4. C. 0 và +4. D. +4 và -4.
268. Trong sự biến đổi: Cu2+ + 2e → Cu, ta thấy:
A. Ion đồng bị oxi hoá. B. Nguyên tử đồng bị oxi hoá.
C. Ion đồng bị khử. D. Nguyên tử đồng bị khử.
269. Phương trình hoá học nào sau đây là phản ứng oxi hoá-khử?
A. 2O3 → 3O2. B. CaO + CO2 → CaCO3.
C. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2. D. BaO + 2HCl → BaCl2 + H2O.
270. Sự biến đổi nào sau đây là sự khử?
271. Phương trình hoá học nào sau đây là phản ứng oxi hoá-khử?
A. 2NaBr + H2SO4 → Na2SO4 + 2HBr. B. H2O + SO2 → H2SO3.
C. MnO2 + 4HCl → MnCl2 + 2H2O + Cl2. D. Ba(OH)2 + H2SO4 → BaSO4 + 2H2O.
272. Phản ứng nào sau đây không là phản ứng oxi hoá-khử?
A. 2Fe + 3Cl2 → 2FeCl3. B. 2Fe(OH)3 → 2Fe2O3 + 3H2O.
C. 2HgO → 2Hg + O2. D. 2Na + 2H2O → 2NaOH + H2.
273. Trong phản ứng hoá học: Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2. Số oxi hoá của nguyên tố oxi:
A. Tăng. B. Giảm. D. Vừa tăng và vừa giảm. C. Không đổi.
274. Trong phản ứng giữa kim loại kẽm và dung dịch đồng (II) sunfat: Zn + CuSO4 → Cu + ZnSO4 một mol Cu2+ đã:
A. Nhường 1 mol electron. B. Nhận 1 mol electron.
C. Nhường 2 mol electron . D. Nhận 2 mol electron.
275. Trong một phản ứng oxi hoá-khử, chất bị oxi hoá là:
A. Chất nhận electron. B. Chất nhường electron.
C. Chất nhận proton. D. Chất nhường proton.
276. Khi phản ứng Fe3+ + Sn2+ → Fe2+ + Sn4+ được cân bằng thì các hệ số của ion Fe3+ và Sn2+ là:
A. 2 và 3. B. 3 và 2. C. 1 và 2. D. 2 và 1.
277. Một mol khí clo (Cl2) bị khử thành ion clorua (Cl-) là do 1 mol khí clo đã:
A. Nhận 1 mol electron. B. Nhường 1 mol electron.
C. Nhường 2 mol electron . D. Nhận 2 mol electron.
278. Khi phản ứng NH3 + O2 → N2 + H2O được cân bằng thì các hệ số của NH3 và O2 là:
A. 2 và 1. B. 3 và 4. C. 1 và 2. D. 4 và 3.
279. Khi phản ứng Ca0 + Al3+ → Ca2+ + Al0 được cân bằng, có:
A. 2 nguyên tử Ca tác dụng với 3 ion Al3+. B. 3 nguyên tử Ca tác dụng với 2 ion Al3+.
C. 3 nguyên tử Ca tác dụng với 1 ion Al3+. D. 1 nguyên tử Ca tác dụng với 3 ion Al3+.
280. Phản ứng của nhôm với đồng: Al + Cu2+ → Al3+ + Cu, trong đó xảy ra:
A. 1 ion Cu2+ oxi hoá 1 nguyên tử Al. B. 2 ion Cu2+ oxi hoá 1 nguyên tử Al.
C. 2 ion Cu2+ oxi hoá 3 nguyên tử Al. D. 3 ion Cu2+ oxi hoá 2 nguyên tử Al.
281. Số mol electron cần có để khử 1,5 mol Al3+ thành Al là:
A. 0,5 mol electron. B. 1,5 mol electron.
C. 3,0 mol electron. D. 4,5 mol electron.
288. Số mol electron sinh ra khi có 2,5 mol Cu bị oxi hoá thành Cu2+ là:
A. 2,50 mol electron B. 1,25 mol electron.
C. 3,0 mol electron D. 5 mol electron.
289. Câu nào diễn tả sai về tính chất các chất trong phản ứng: 2FeCl2 + Cl2 → 2FeCl3.
A. Ion Fe2+ khử nguyên tử Cl. B. Nguyên tử Cl oxi hoá ion Fe2+.
C. Ion Fe2+ bị oxi hoá D. Ion Fe2+ oxi hoá nguyên tử Cl.
290. Câu diễn tả đúng tính chất các chất trong phản ứng là: Cu0 + Cl2 → CuCl2
A. Cu0 bị khử, Cl2 bị oxi hoá. B. Cu0 bị oxi hoá, Cl2 bị khử.
C. Cu2+ bị khử, Cl- bị oxi hoá. D. Cu2+ bị oxi hoá, Cl- bị khử.
291. Trong phản ứng phân huỷ:  →
→  +
+  , chất bị oxi hoá là:
, chất bị oxi hoá là:
292. Trong phản ứng: Na2SO4 + BaCl2 → 2NaCl + BaSO4.
A. Na2SO4 bị khử. B. Na2SO4 bị oxi hoá.
C. BaCl2 bị khử. D. Không chất nào bị oxi hoá và bị khử.
293. Trong phản ứng: Cu + 4HNO3 → 2NO2 + Cu(NO3)2 + H2O, chất bị oxi hoá là:
294. Trong phản ứng sau: ..Cr0 +... Sn2+→ ...Cr3++.... Sn0. Hệ số của các chất phản ứng và sản phẩm lần lượt:
A. 3,2,3,2. B. 2,2,3,3. C. 2,3,2,3. D. 3,3,2,2.
295. Trong phản ứng: ...Fe3+ + ...Sn2+ → ..Fe2+ + ...Sn4+. Hệ số của các chất phản ứng và sản phẩm lần lượt
A. 1,2,1,2. B. 2,1,2,1. C. 2,2,1,1. D. 1,1,2,2.
296. Trong phản ứng: ..KMnO4 + ...HCl → ..KCl + ..MnCl2 + ..H2O + ...Cl2. Hệ số của các chất phản ứng và sản phẩm lần lượt là:
A. 2,16,2,2,8,5. B. 16,2,1,1,4,3. C. 1,8,1,1,4,3. D. 2,16,1,1,4,5.
297. Phản ứng phân huỷ: ..KMnO4  ...K2MnO4 + ..MnO2 + ...O2. Sau khi cân bằng, các chất phản ứng và sản phẩm có hệ số lần lượt:
...K2MnO4 + ..MnO2 + ...O2. Sau khi cân bằng, các chất phản ứng và sản phẩm có hệ số lần lượt:
A. 2,2,2,1. B. 2,1,1,1. C. 2,1,2,1. D. 1,2,1,2.
298. Cho biết phương trình hoá học: Zn + 2HCl → ZnCl2 + H2 chất nào bị oxi hoá?
A. Ion H+. B. Ion Cl- C. Nguyên tử Zn. D. Phân tử 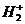
299. Kim loại nào sau đây có tính khử mạnh nhất?
A. Canxi (Ca). B. Magie (Mg). C. Stronti (Sr). D. Bari (Ba).
300. Cho biết phương trình hoá học: Zn + 2AgNO3 → Zn(NO3)2 + 2Ag. Trong quá trình phản ứng:
A. Khối lượng kim loại Zn tăng dần. B. Khối lượng kim loại Ag giảm dần.
C. Nồng độ ion Zn2+ trong dd tăng dần. D. Nồng độ ion Ag+ trong dd tăng dần.
301. Sự biến đổi nào sau đây phù hợp với sự bảo toàn điện tích?
A. Fe → Fe2+ + e. B. Fe + 2e → Fe2+.
C. Fe → Fe2+ + 2e . D. Fe + 2e →Fe3+.
302. Phản ứng oxi hoá khử xảy ra là do có sự di chuyển của:
A. Ion. B. Nơtron. C. Proton. D. Electron.
303. Nguyên tố crom trong hợp chất kali đicromat có số oxi hoá là:
A. +6. B. -6. C. +7. D. -12.
304. Cho phản ứng: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng này xảy ra sự oxi hoá nào sau đây?
A. Fe2+ + 2e → Fe . B. Fe → Fe2+ + 2e. C.Cu2+ + 2e → Cu. D. Cu → Cu2+ + 2e.
305. Phản ứng oxi hoá-khử nào sau đây đã cân bằng không đúng?
A. Zn(r) + Cu2+ (dd) → Cu(r) + Zn2+ (dd). B. Ni(r) + Sn2+ (dd) → Sn(r) + Ni2+ (dd).
C. 2I- (dd) + Fe3+(dd) → Fe2+ + I2(r). D. 2I-(dd) + Hg2+→ (dd) Hg(l) + I2(r).
306. Trong phản ứng điện phân 2NaCl → 2Na + Cl2, xảy ra:
A. Ion Cl- bị khử. B. Ion Na+ bị oxi hoá.
C. Ion Cl- bị oxi hoá. D. Không có ion nào bị oxi hoá hay bị khử.
307. Vai trò các chất trong phản ứng oix hoá khử: Pb(r) + Cu2+ (dd) → Pb2+ (dd) + Cu(r).
A. Pb bị oxi hoá và Cu bị khử. B. Pb2+ bị oxi hoá và Cu2+ bị khử.
C. Pb2+ bị oxi hoá và Cu bị khử. D. Pb bị oxi hoá và Cu2+ bị khử.
308. Cho phản ứng sau: ...Ag2S + 8HNO3 → ...AgNO3 + 2NO +...S + ...H2O. Sau khi phản ứng được cân bằng, hệ số các chất Ag2S, AgNO3, S và H2O lần lượt là:
A. 6,3,12,4. B. 3,6,3,4. C. 3,3,3,4. D. 1,2,1,4.
309. Hợp chất nào sau đây chứa nguyên tố photpho có số oxi hoá +3?
A. P2O5. B. PCl5. C. Ca3(PO4)2. D. KH2PO3.
400. Cho phản ứng oxi hoá khử: 2Cr(r) + 3Sn2+ (dd) → 2Cr3+ (dd) + 3Sn(r). Chất oxi hoá là:
A. Cr. B. Cr3+ . C. Sn2+ . D. Sn.
401. Sự biến đổi hoá học nào sau đây là sự khử?
A. Fe(r) → Fe3+ (dd) + 2e. B. Fe (r) → Fe3+ (dd) + 3e.
C. Fe2+ (dd) → Fe3+ (dd) + e. D. Fe3+ (dd) + 1e → Fe2+ (dd).
402. Trong một phản ứng oxi hoá-khử, số oxi hoá của chất oxi hoá:
A. Tăng. B. Giảm.
C. Có thể tăng và có thể giảm. D. Không thay đổi.
403. Điều gì xảy ra trong quá trình phản ứng? 4HCl + MnO2 → MnCl2 + 2H2O + Cl2.
A. Mangan bị oxi hoá vì số oxi hoá của nó tăng từ +2 đến +4.
B. Mangan bị oxi hoá vì số oxi hoá của nó giảm từ +4 đến +2.
C. Mangan bị khử vì số oxi hoá của nó giảm từ +4 đến +2.
D. Mangan bị khử vì số oxi hoá của nó tăng từ +2 đến +4.
404. Cho phản ứng oxi háo khử: Ag+ (dd) + Fe2+ (dd) → Ag(r) + Fe3+ (dd). Vai trò các chất trong phản ứng:
A. Ag+ là chất oix hoá và Fe2+ là chất khử. B. Ag+ là chất khử và Fe2+ là chất oxi hoá.
C. Ag+ là chất oxi hoá và Fe3+ là chất khử. D. Fe3+ là chất oxi hoá và Fe2+ là chất khử.
405. Kim loại kẽm (Zn) không khử được:
A. Cu2+ (dd). B. H+ (dd). C. Ag+ (dd). D. Al3+ (dd).
406. Cho phản ứng: ..NH3 + ...O2 → ...NO + ...H2O. Sau khi phản ứng được cân bằng, hệ số các chất phản ứng và sản phẩm lần lượt:
A. 1, 1, 1, 1. B. 2, 1, 2, 3. C. 2, 5, 2, 3. D. 4, 5, 4, 6.
 407. Vai trò các chất tham gia phản ứng là: HClO + HCl Cl2 + H2O.
407. Vai trò các chất tham gia phản ứng là: HClO + HCl Cl2 + H2O.
A. HClO là chất khử, HCl là chất oxi hoá. B. HClO là chất bị oxi hoá, HCl là chất khử.
C. HClO là chất oxi hoá, HCl là chất khử. D. HClO và HCl cùng là chất oxi hoá.
408. Kim loại nào có tính khử mạnh nhất?
A. Fe. B. Pb. C. Ag. D. Na.
409. Sau khi cân bằng phản ứng oxi hoá-khử: ... + Sn2+ +...H+ → ..Mn2+ + ...Sn4+ + ...H2O. Hãy cho biết tỉ lệ số mol ion chất khử đối với số mol ion chất oxi hoá:
+ Sn2+ +...H+ → ..Mn2+ + ...Sn4+ + ...H2O. Hãy cho biết tỉ lệ số mol ion chất khử đối với số mol ion chất oxi hoá:
A. 1 : 1. B. 2 : 1. C. 4 : 1 . D. 5 : 2.
410. Cho biết số mol khí oxi tham gia phản ứng oxi hoá-khử? ...H2S + ...O2 → ..SO2 + ...H2O.
A. 2. B. 5. C. 4. D. 3.
411. Sau khi cân bằng đúng phản ứng oxi hoá-khử: ..Cu + ...HNO3 → ..Cu(NO3)2 + ...NO + ...H2O. Số phân tử HNO3 tạo muối nitrat và số phân tử HNO3 bị khử là:
A. 3 và 2. B. 6 và 2. C. 8 và 6. D. 8 và 2.
412. Sau khi cân bằng phản ứng oxi hoá-khử: Al + HNO3 → Al(NO3)3 + N2O + H2O. Tổng số hệ số các chất phản ứng và tổng số hệ số các sản phẩm là:
A. 26 và 26. B. 19 và 19. C. 38 và 26. D. 19 và 13.
413. Sau khi phản ứng đã được cân bằng: Mg + HNO3 → Mg(NO3)2 + N2 + H2O. Tổng số hệ số các chất trong phương trình phản ứng là:
A. 29. B. 25. C. 28. D. 32.
414. Số oxi hoá của lưu huỳnh trong phân tử axit sunfuric H2SO4 và trong phân tử muối sunfat:
A. luôn bằng +6. B. bằng +6 và +4. C. luôn bằng +4. D. bằng +4 và +6.
415. Cho biết: NaCl + SO3 → Cl2 + SO2 + Na2S2O7. Phản ứng trên sau khi cân bằng có số phân tử SO3 bị khử thành SO2 và số phân tử SO3 tạo muối Na2S2O7 là:
A. 3 và 1. B. 1 và 3. C. 2 và 1. D. 1 và 2.
416. Cho sơ đồ của phản ứng hoá học sau: KMnO4 + FeSO4 + H2SO4 → K2SO4 + Fe2(SO4)3 + MnSO4 + H2O. Trong phản ứng trên, số oxi hoá của sắt:
A. tăng từ +2 lên +3. B. giảm từ +3 xuống +2. C. tăng từ -2 lên +3. D. không thay đổi.
417. Trong hợp chất, số oxi hoá cao nhất của mọi nguyên tố đều bằng:
A. số thứ tự của nhóm nguyên tố trong bảng tuần hoàn các nguyên tố hoá học.
B. số thứ tự chu kỳ. C. số thứ tự của ô nguyên tố.
D. số electron lớp ngoài cùng.
418. Số oxi hoá của S trong các chất S8, H2SO4, Na2SO4, CaSO3, NaHS lần lượt bằng:
A. -8, +6, +6, +4, -2. B. 0, +6, +4, +4, -2.
C. 0, +6, +6, +4, -2. D. 0, +6, +6, +4, +2.
419. Cho PTHH của các phản ứng hoá học sau:
a, Fe + CuSO4 → FeSO4 + Cu. b, S + O2 → SO2.
c, NaCl + AgNO3 → NaNO3 + AgCl. d, 2KMnO4 → K2MnO4 + MnO2 + O2.
e, HCl + AgNO3 → HNO3 + AgCl. f, 2KClO3 → 2KCl + 3O2.
g, 2HCl + CaCO3 → CaCl2 + H2O + CO2. h, Cl2 + 2NaBr → Br2 + 2NaCl.
1, Các phản ứng thuộc loại phản ứng oxi hoá-khử là:
A. a,b,c,d,e. B.a,b,d,h. C. b,c,d,e,g. D. a, b, d, f, h.
2, Các phản ứng thuộc loại phản ứng thế là:
A. a,b,c,d,e,h. B. a,h. C. b,c,d,e,f,h. D. a,c,d,e,h.
3, Các phản ứng thuộc loại phản ứng phân huỷ là:
A. a,b,c,d,e. B. a,b,d,g. D. a,c,d,e,f,g,h. C. d,f.
4, Các phản ứng thuộc loại phản ứng trao đổi là:
A. c,e,g. B. a,b,d,g. C. d,f,h. D. a,c,d,e,f.
420. Kết luận nào sau đây là đúng?
A. Phản ứng toả nhiệt là phản ứng có ∆H < 0. B. Phản ứng toả nhiệt là phản ứng có ∆H > 0.
C. Phản ứng thu nhiệt là phản ứng có ∆H < 0. D. Phản ứng toả nhiệt là phản ứng có ∆H ≥ 0.
421. Cho các phương tình nhiệt hoá học sau:
a, H2(k) + Cl2(k) → 2HCl (k) ∆H = - 185,7 kJ
b,2HgO (r) → 2Hg(h) + O2 (k) ∆H = + 90kJ
c, 2H2(k) + O2(k) → 2H2O (k) ∆H = - 571,5kJ. Các phản ứng toả nhiệt là:
A. a,b,c. B. a, b. C. a,c. D. b, c.
422. Cho các phản ứng hoá học sau: CrCl3 + NaOCl + NaOH → Na2CrO4 + NaCl + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 2, 6, 4, 2, 3, 4. B. 4, 6, 8, 4, 3, 4. C. 2, 3, 10, 2, 9, 5. D. 2, 4, 8, 2, 9, 8.
423. Cho các phản ứng hoá học sau:
HNO3 + H2S → NO + S + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 2, 3, 2, 3, 4. B. 2, 6, 2, 2, 4. C. 2, 2, 3, 2, 4. D. 3, 2, 3, 2, 4
424. Trong các câu sau, câu nào đúng:
1, Trong phản ứng hoá học, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
2, Trong phản ứng thế, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
3, Trong phản ứng phân huỷ, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
4, Trong phản ứng hoá hợp, số oxi hoá của các nguyên tố không thay đổi.
5, Trong phản ứng trao đổi, số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi.
6, Trong phản ứng trao đổi, số oxi hoá của các nguyên tố không thay đổi.
7, Trong phản ứng thế, số oxi hoá của các nguyên tố luôn thay đổi.
A. 1,2,3,4,5,6,7. B. 1,3,6,7. C. 1,2,3,4,5. D. 1,2,5,6,7.
425. Cho các phản ứng sau:
1, 2SO2 + O2 → SO3. 2, SO2 + 2H2O + Br2 → H2SO4 + 2HBr.
3, SO2 + 2H2S → 2H2O + 3S.
4, SO2 + Cl2 → SO2Cl2. 5, SO2 + 2Mg → S + 2MgO.
a, Trong các phản ứng trên,
A. SO2 chỉ có tính oxi hoá. B. SO2 chỉ có tính khử.
C. SO2 vừa có tính oxi hoá vừa có tính khử. D. SO2 luôn có tính chất của oxit axit.
b, Các phản ứng trong đó SO2 đóng vai trò chất oxi hoá là:
A. 2,3,4,5. B. 1,3,5. C. 1,2,3,4,5. D. 3,5.
c, Các phản ứng trong đó SO2 đóng vai trò chất khử là:
A. 2,3,4,5. B. 1,3,5. C. 1,2,4. D. 1,3,4,5.
426. Cho các câu sau, câu nào đúng:
1, Chất khử là chất nhường electron. 2, Chất oxi hoá là chất nhường electron.
3, Phản ứng oxi hoá-khử là phản ứng có sự thay đổi số oxi hoá của một số nguyên tố.
4, Phản ứng oxi hoá-khử là phản ứng chỉ có sự tăng số oix hoá của một số nguyên tố.
5, Phản ứng oxi hoá-khử là phản ứng chỉ có sự giảm số oxi hoá của một số nguyên tố.
6, Chất khử là chất nhận electron. 7, Chất oxi hoá là chất nhận electron.
A. 1,3,4,5,6,7. B. 1,3,7. C. 1,2,3,4,5. D. 1,2,5,6,7.
427. Cho các phản ứng sau:
 1, Cl2 + H2O HOCl + HCl 2, Cl2 + 2H2O + SO2 → H2SO4 + 2HCl.
1, Cl2 + H2O HOCl + HCl 2, Cl2 + 2H2O + SO2 → H2SO4 + 2HCl.
3, Cl2 + H2S → 2HCl + S. 4, Cl2 + SO2 → SO2Cl2.
5, Cl2 + Mg → MgCl2 6, Cl2 + Ca(OH)2 → CaOCl2 + H2O.
a, Clo giữ vai trò là chất oxi hoá trong các phản ứng:
A. 1,2,3,4. B. 1,2,3,6. C. 3,4,5,6. D. 1,2,3,4,5,6.
b, Trong các phản ứng trên,
A. clo chỉ thể hiện tính oxi hoá. B. clo luôn giữ vai trò chất tính khử.
C. clo vừa thể hiện tính oxi hoá vừa thể hiện tính khử. D. clo luôn có tính chất của oxit axit.
428. Cho các PTHH sau:
a, Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O b, Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
c, 2Cu + O2 → 2CuO Kết luận nào sau đây đúng?
A. Trong các phản ứng trên Cu là chất oxi hoá vì trong quá tình phản ứng số oxi hoá củanó tăng.
B. Trong các phản ứng trên Cu là chất khử vì trong quá trình phản ứng số oxi hoá của nó tăng.
C. Trong các phản ứng trên Cu là chất oxi hoá vì trong quá tình phản ứng số oxi hoá của nó giảm lên.
D. Trong các phản ứng trên Cu không phải là chất oxi hoá cũng không phải là chất khử vì trong quá trình phản ứng số oxi hoá của nó không bị thay đổi.
429. Cho các phản ứng hoá học sau: Cu + HCl + NaNO3 → CuCl2 + NO + NaCl + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 3, 4, 2, 3, 3, 2, 4. B. 2, 6, 2, 6, 4, 2, 4. C. 3, 4, 2, 3, 4, 2, 4. D. 3, 8, 2, 3, 2, 2,4.
430. Cho phản ứng hóa học sau: K2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 5, 2, 4, 5, 2, 6, 4. B. 5, 4, 4, 5, 2, 6, 4. C. 5, 4, 8, 5, 2, 6, 4. D. 5, 2, 8, 5, 2, 6,8.
431. Trong phòng thí nghiệm, người ta thường điều chế oxi bằng cách nhiệt phân một số hợp chất, thí dụ theo các phản ứng sau:
a, 2KMnO4 → K2MnO4 + MnO2 + O2. b, 2KClO3 → 2KCl + 3O2. c, 2KNO3 → 2KNO2 + O2.
Đặc điểm chung của các phản ứng trên là:
A. Oxi trong phân tử hợp chất bị oxi hoá từ số oxi hoá -2 lên số oxi hoá 0.
B. Oxi trong phân tử hợp chất bị khử từ số oxi hoá 0 lên số oxi hoá -2.
C. Oxi trong phân tử hợp chất bị khử từ số oxi hoá -2 lên số oix hoá 0.
D. Oxi trong phân tử hợp chất bị khử từ số oxi hoá -1 lên số oxi hoá 0.
432. Cho PTHH sau: xKMnO4 + yHCl → zKCl + rMnCl2 + pCl2 + qH2O.
1, Trong phản ứng trên, số oxi hoá của clo:
A. tăng từ -1 lên 0. B. giảm từ -1 lên 0.
C. giảm từ -1 xuống 0. D. tăng từ -1 xuống 0.
2, Trong phản ứng trên, số oxi hoá của mangan:
A. tăng từ +1 lên +2. B. giảm từ +2 lên +7
C. giảm từ +7 xuống +2 D. tăng từ 7+ xuống 2+.
3, Trong phản ứng trên:
A.  là chất oxi hoá, còn
là chất oxi hoá, còn  là chất khử. B.
là chất khử. B.  là chất khử, còn
là chất khử, còn  là chất oxi hoá.
là chất oxi hoá.
C.  là chất bị oxi hoá, còn
là chất bị oxi hoá, còn  là bị chất khử. D.
là bị chất khử. D.  là chất oxi hoá, còn
là chất oxi hoá, còn  là chất khử.
là chất khử.
433. Cho amoniac NH3 tác dụng với oxi ở nhiệt độ cao có xúc tác thích hợp sinh ra nitơ oxit NO và nước. PTHH là: 4NH3 + 5O2 → 4NO + 6H2O. Trong phản ứng trên, NH3 đóng vai trò:
A. là chất oxi hoá. D. Vừa oxi hoá vừa khử. B. là chất khử. C. là một bazơ.
434. Cho kim loại M (Z = 12) tác dụng với dung dịch axit nitric xảy ra phản ứng có PTHH sau:
aM + bHNO3 → cM(NO3)n + dNO + eH2O.
1, Trong phản ứng trên, M đóng vai trò:
A. là chất oxi hoá. B. là chất khử C. là một bazơ D. là một axit.
2, Trong muối M(NO3)n, n nhận giá trị:
A. 1 B. 2 C. 3 D. 4.
435. Cho phản ứng hóa học sau: Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 4, 5, 4, 1, 3. B. 4, 8, 4, 2, 4. C. 4, 10, 4, 1, 3. D. 2, 5, 4, 1, 6
436 Cho phản ứng hóa học sau: CuS2 + HNO3 → Cu(NO3)2 + H2SO4 + N2O + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 4, 22, 4, 8, 7, 3. B. 4, 12, 4, 4, 7, 3. C. 3, 12, 4, 8, 7, 6. D. 4, 22, 4, 4, 7, 4.
437. Cho phản ứng hóa học sau: K2Cr2O7 + KI + H2SO4 → Cr2(SO4)3 + I2 + K2SO4 + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 2, 3, 4, 1, 3, 2, 4. B. 2, 6, 3, 1, 3, 4, 4. C. 1, 4, 7, 2, 3, 4, 7. D. 1,6, 7, 1, 3, 4, 7.
438. Cho các phản ứng hoá học sau: FeS2 + HNO3 + HCl → FeCl3 + H2SO4 + NO + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 2, 5, 6, 1, 2, 10, 4. B. 3, 5, 3, 1, 2, 3, 2. C. 1, 10, 6, 1, 2, 5, 2. D. 1, 5, 3, 1, 2,5, 2.
439. Cho các phản ứng hoá học sau: CrCl3 + Br2 + NaOH → Na2CrO4 + NaBr + NaCl + H2O.
Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 2, 3, 16, 2, 6, 6, 8. B. 4, 6, 32, 4, 12, 12, 16. D. 4, 3, 32, 2, 12, 12, 8. C. 2, 3, 4, 2, 3, 3,4.
440. Cho các chất và ion sau: Cl-, Na2S, NO2, Fe2+, SO2, Fe3+, N2O5,  ,
,  , MnO, Na, Cu. Các chất, ion nào vừa có tính khử vừa có tính oxi hoá:
, MnO, Na, Cu. Các chất, ion nào vừa có tính khử vừa có tính oxi hoá:
A. Cl-, Na2S, NO2, Fe2+. B. NO2, Fe2+, SO2, MnO,  .
.
C. Na2S, Fe3+, N2O5, MnO. D. MnO, Na, Cu.
441. Cho các phản ứng hoá học sau: FeS2 + O2  Fe2O3 + SO2↑. Hệ số cân bằng của các phản ứng trên lần lượt là:
Fe2O3 + SO2↑. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 4, 5, 2, 4. B. 4, 11, 2, 8. C. 4, 6, 2, 8. D. 4, 11, 12, 8.
442. Cho các phản ứng hoá học sau: FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO2↑ + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 2,14,1,2,5,7. B. 3,14,1,4,30,14. C. 1.9.1.4.15.7. D. 1, 18, 1, 2,15, 7.
443. Cho các phản ứng hoá học sau: FeS + HNO3 → Fe(NO3)3 + H2SO4 + NO2↑ + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 2, 12, 1, 2, 9, 5. B. 3, 12, 1, 2, 3, 5. C. 1, 12, 1, 1, 9, 5. D. 1, 6, 1, 1, 3, 5.
444. Cho các phản ứng hoá học sau: KNO3 + FeS → KNO2 + Fe2O3 + SO3↑. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 9, 4, 9, 1, 6. B. 3, 2, 9, 4, 6. C. 9, 2, 9, 1, 2 D. 9, 4, 3, 1, 3.
445. As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO. Hệ số cân bằng của phản ứng lần lượt là:
A. 3, 4, 6, 9, 4, 4. B. 1, 7, 2, 3, 1, 7. C. 1, 28, 4, 2, 3, 28. D. 3, 28, 4, 6, 9,28.
446. Cho phản ứng hoá học sau: CuFeS2 + Fe2(SO4)3 + O2 + H2O → CuSO4 + FeSO4 + H2SO4. Hệ số cân bằng của các phản ứng trên lần lượt là
A. 6, 8, 8, 4, 6, 12, 16. B. 3, 8, 8, 8, 3, 19, 8.
C. 6, 8, 16, 16, 6, 24, 16. D. 6, 16, 16, 16, 6, 38, 16
447. Cho phản ứng hoá học sau: As2S3 + KClO4 + H2O → H3AsO4 + H2SO4 + KCl. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 3, 28, 16, 6, 24, 16. B. 6, 14, 18, 12, 18, 14.
C. 2, 7, 12, 4, 6, 7. D. 6, 14, 36, 12, 18, 14
448. Cho phản ứng hoá học sau: Cu2S + HNO3 → Cu(NO3)2 + CuSO4 + NO + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 3, 8, 3, 4, 5, 4. B. 2, 8, 2, 3, 4, 4.
C. 3, 8, 3, 3, 10, 4. D. 3, 16, 3, 3, 10, 8
449. Cho phản ứng hoá học sau: KI + KClO3 + H2SO4 → K2SO4 + I2 + KCl + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 6,1, 3, 3, 3, 1, 3. B. 6, 3, 3, 3, 2, 13.
C. 6, 2, 3, 3, 3, 16. D. 3, 1, 3, 2, 2, 1, 3.
450. Cho các phản ứng hoá học sau: Fe2O3 + Al  FenOm + Al2O3. Hệ số cân bằng của các phản ứng trên lần lượt là:
FenOm + Al2O3. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 3n, (6n-4m), 6, (3n-2m). B. 4, (3n-2m), 3, (n-3m).
C. 3n, (3n-2m), 3, (2n-2m). D. n, (2n-m), 6, (3n-2m)
451. Cho các phản ứng hoá học sau: FenOm + HNO3 → Fe(NO3)3 + NO + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là
A. 3, (6n-2m), n, (3n-m), (6n-m). B. 2, (3n-2m), 3n, (3n-2m).
C. 3, (6n-m), 3n, (3n-2m), (n-m). D. 3, (12n-2m), 3n, (3n-2m), (6n-m).
452. Cho các phản ứng hoá học sau: Fe3O4 +  + H+ → Fe3+ + NxOy + H2O. Hệ số cân bằng lần lượt:
+ H+ → Fe3+ + NxOy + H2O. Hệ số cân bằng lần lượt:
A. (5x-2y), 3x, (3x-y), (3x-2y),1, (13x-y). B. (5x-2y), x, (x-y), (2x-2y),1, (23x-9y).
C. (x-2y), 4x, (6-8y), (15x-6y), 1, (13x-y). D. (5x-2y), x, (46x-18y), (15x-6y), 1, (23x-9y).
453. Cho các phản ứng hoá học sau: HxIyOz + H2S → I2 + S + H2O. Hệ số cân bằng lần lượt là:
A. 2, (2z-x), y, (2z-x), 2z. B. 4, (3z-2x), y, (2z-x), 2z.
C. 3, (4z-x), 4y, (4z-y), 3z. D. 2, (2z-x), y, (2z-x), 4z.
454. Cho các phản ứng hoá học sau:  +
+  + H+ → Mn2+ +
+ H+ → Mn2+ +  + H2O. Hệ số cân bằng lần lượt:
+ H2O. Hệ số cân bằng lần lượt:
A. 2, 6, 6, 3, 5, 3. B. 4, 3, 6, 2, 2, 3. C. 4, 5, 3, 3, 3, 2. D. 2, 5, 6, 2, 5, 3.
455. Cho các phản ứng hoá học sau: MnO2 + H+ + Cl- → Cl2 + H2O + Mn2+. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 3, 4, 2, 1, 1, 1. B. 2, 4, 2, 1, 2, 1. C. 1, 6, 1, 1,1, 2. D. 1, 4, 2, 1, 2,
456. Cho các phản ứng hoá học sau: O3 + Cl- + H+ → Cl2 + O2 + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 1, 2, 1, 1, 1, 1. B. 1, 2, 2, 1, 1, 1. C. 1, 2, 1, 2, 2, 2. D. 3, 4, 2, 1, 1, 2.
457. Cho các phản ứng hoá học sau:  + Cl- + H+ → Cl2 + H2O + Mn2+. Hệ số cân bằng của các phản ứng trên lần lượt là
+ Cl- + H+ → Cl2 + H2O + Mn2+. Hệ số cân bằng của các phản ứng trên lần lượt là
A. 3, 5, 8, 5, 4, 2. B. 2, 5, 8, 5, 4, 2. C. 5, 5, 8, 4, 4, 1. D. 2, 10, 16, 5, 8,2.
458. Cho các phản ứng hoá học sau:  + Cl- + H+→ Cr3+ + Cl2 + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
+ Cl- + H+→ Cr3+ + Cl2 + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 1, 6, 7, 2, 3, 7. B. 1, 6, 7, 2, 3, 4. C. 1, 6, 14, 2, 3, 7. D. 2, 8, 14, 2, 6, 7.
459. Cho các phản ứng hoá học sau: Fe3O4 + HNO3 → Fe(NO3)3 + NxOy + H2O. Hệ số cân bằng của các phản ứng hoá học trên lần lượt là:
A. (5x-2y), (23-9y), (15x-2y), 2, (13x-9y). B. (x-2y), (13-9y), (5x-2y), 1, (10x-y).
C. (5x-2y), (46x-18y), (15x-6y), 1, (23x-9y). D. (5x-2y), (23x-8y), (15x-16y), 1, (23x-9y).
460. Cho các phản ứng hoá học sau: Hoà tan kim loại M trong dd HNO3 thu được một muối nitrat, khí NxOy và H2O. Hệ số cân bằng của các phản ứng hoá học trên lần lượt là:
A. (5x-2y), (3nx-2ny), (x-2y), 2n, (nx-2ny). B. (5x-2y), (6nx-ny), (3x-2y), n, (2nx-2ny).
C. (3x-2y), (3nx-ny), (x-2y), 3n, (2nx-y). D. (5x-2y), (6nx-2ny), (5x-2y), n, (3nx-ny)
461. Cho các phản ứng hoá học sau: FeO + HNO3 → NxOy↑ + Fe(NO3)3 + H2O. Hệ số cân bằng của các phản ứng hoá học trên lần lượt là:
A. (5x-2y), (16x-16y), 1, (5x-2y), (8x-3y). B. (5x-2y), (x-y), (x-2y), 1, (x-3y).
C. (x-2y), (x-y), (2x-2y),2, (x-5y). D. (3x-y), (x-3y), (3x-3y), 3, (2x-6y)
462. Cho các phản ứng hoá học sau: Khi cho một kim loại vào dung dịch HNO3 ta thu được hai loại muối.
A. 8, 16n, 8, 5n, 6n. B. 2, 8n, 4n, 5, 6. C. 8, 8n, n, 5, 6n. D. 8, 10n, 8, n, 3n.
463. Cho phản ứng hoá học sau: MxOy + HNO3 → M(NO3)n + NO + H2O. Hệ số cân bằng của pứ lần lượt:
A. 3, (nx-2y), 2x, (2nx-y), (nx-y). B. 6, (nx-2y), x, (nx-y), (3nx-y).
C. 2, (3nx-3y), 2x, (2nx-2y), (2nx-2y). D. 3, (4nx-2y), 3x, (nx-2y), (2nx-y).
464. Cho phản ứng hoá học sau: Al + HNO3 → Al(NO3)3 + NO + N2O + H2O. Hệ số cân bằng của phản ứng trên lần lượt là:
A. 11, 42, 11, 3, 3, 21. B. 12, 42, 12, 3, 3, 21.
C. 11, 44, 11, 3, 3, 22. D. 11, 40, 11, 3, 3, 20.
465. Cho phương trình phản ứng: Al + HNO3 → Al(NO3)3 + N2O + N2 + H2O. Nếy tỉ lệ mol giữa N2O và N2 là 2 : 3 thì sau khi cân bằng ta có tỉ lệ mol nAl : n : nN2 lần lượt là:
: nN2 lần lượt là:
A. 23 : 4 : 6. B. 46 : 6 : 9. C. 46 : 2 : 3. D. 20 : 2 : 3.
466. Cho m gam nhôm phản ứng hết với dung dịch axit nitric thu được 8,96 lít (đktc) hỗn hợp khí NO và N2O có tỉ khối hơi so với hiđro bằng 16,5. Khối lượng m có giá trị là:
A. 15, 3 B. 14, 85. C. 12, 3. D. 16, 679.
467. Cho các phản ứng hoá học sau: KClO3 + NH3  KNO3 + KCl + Cl2↑ + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
KNO3 + KCl + Cl2↑ + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 3, 4, 4, 1, 1, 2. B. 2, 3, 3, 1, 1, 2. C. 3, 2, 2, 1, 1, 3. D. 3, 1, 2, 1, 1, 3.
468. Cho các phản ứng hoá học sau: KNO3 + FeS2  KNO2 + Fe2O3 + SO3. Hệ số cân bằng của các phản ứng trên lần lượt là:
KNO2 + Fe2O3 + SO3. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 15, 4, 10, 1, 3. B. 15, 3, 15, 2, 6. C. 5, 6, 5, 3, 7. D. 15, 2, 15, 1, 4.
469. Cho phản ứng hoá học sau: Al + H2O + NaOH →NaAlO2 + H2↑. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 2, 3, 2, 3, 3 . B. 1, 2, 2, 1, 1. C. 2, 4, 4, 4, 3. D. 2, 2, 2, 2, 3.
470. Cho phản ứng hoá học sau: K2SO3 + KMnO4 + KHSO4 → K2SO4 + MnSO4 + H2O. Hệ số cân bằng của các phản ứng trên lần lượt là:
A. 5, 4, 6, 3, 4, 6 B. 2, 5, 6, 3, 2, 3. C. 5, 2, 6, 9, 2, 3. D. 5, 4, 6, 9, 2,6.
471 Bán kính nguyên tử của các nguyên tố: 3Li, 8O, 9F, 11Na được xếp theo thứ tự tăng dần từ trái sang phải:
A. F, O, Li, Na. B. F, Na, O, Li. C. F, Li, O, Na. D. Li, Na, O, F.
472. Dãy các nguyên tố sắp xếp theo chiều tăng dần tính phi kim từ trái sang phải:
A. P, N, F, O. B. N, P, F, O. C. P, N, O, F. D. N, P, O, F.
473. Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí của nguyên tố X với hiđro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là:
A. 50,00%. B. 27,27%. C. 60,00%. D. 40,00%.
474. Cho phương trình hóa học: Fe3O4 + HNO3 → Fe(NO3)3 + NxOy + H2O. Sau khi cân bằng phương trình hóa học trên với hệ số các chất là những số nguyên, tối giản thì hệ số của HNO3 là:
A. 13x - 9y. B. 46x - 18y. C. 45x - 18y. D. 23x - 9y.
475. Cấu hình electron của ion X2+ là 1s22s22p63s23p63d6. Trong bảng tuần hoàn các nguyên tố hóa học, nguyên tố X thuộc:
A. chu kỳ 4, nhóm VIIIA. B. chu kỳ 4, nhóm IIA.
C. chu kỳ 3, nhóm VIB. D. chu kỳ 4, nhóm VIIIB.
476. Nhận định nào sau đây đúng khi nói về 3 nguyên tử: ,
,  ,
,  ?
?
B. X, Z là 2 đồng vị của cùng một nguyên tố hóa học. A. X và Y có cùng số khối.
C. X, Y thuộc cùng một nguyên tố hóa học. D. X và Z có cùng số nơtron.
477. Một ion M3+ có tổng số hạt proton, nơtron, electron là 79, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cấu hình electron của nguyên tử M là
A.[Ar] 3d54s1. B.[Ar] 3d64s2. C.[Ar] 3d64s1. D.[Ar] 3d34s2.
TỰ LUẬN:
CHƯƠNG I:
Bài 1: Xác định số hiệu nguyên tử của các nguyên tố và viết cấu hình e nguyên tử của nó khi biết:
a. Nguyên tố A có tổng số hạt của các nguyên tử là 40
b. Nguyên tố B có tổng số hạt là 92. Số hạt mang điện nhiều hơn số hạt không mang điện là 24 hạt
Bài 2: Ion M+ và X2- đều có cấu hình e như sau: 1s22s22p63s23p6
a. Viết cấu hình e của M và X
b. Tính tổng số hạt mang điện của hợp chất tạo nên từ 2 ion trên
Bài 5: Nguyên tử X có số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt và có số nơtron chiếm
35,294% tổng số hạt.
a) Viết kí hiệu nguyên tử X.
b) Hợp chất M có công thức XaYb , trong đó tổng số proton và tổng số nguyên tử trong phân tử M lần
lượt là 30 và 3. Xác định công thức phân tử của M. (ĐS: Na2O)
Bài 6: Đồng vị X1của nguyên tố X được cấu tạo bởi 54 hạt. Trong hạt nhân đồng vị X1, số hạt không mang điện nhiều hơn số hạt mang điện là 3 hạt.
a) Viết kí hiệu nguyên tử X1.
b) Đồng vị còn lại X2của nguyên tố X có tỉ lệ số không hạt mang điện và tổng số hạt mang điện là 917
. Tính % số nguyên tử và % khối lượng của từng đồng vị biết NTKTB của X = 35,5.
(ĐS: 75%; 25% và 73,9
Bài 8: Hợp chất M được tạo thành từ cation X và anion Y2-. Mỗi ion đều do 5 nguyên tử của 2 nguyên tố tạo
nên. Tổng số proton trong Xlà 11, còn tổng số electron trong Y2- là 50. Biết 2 nguyên tố trong thuộc cùng một nhóm A và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Xác định CT phân tử của M.
(ĐS: (NH4)2SO4 )
Bài 9: Nguyên tố X có hóa trị cao nhất với oxi cao 3 lần hóa trị trong hợp chất khí với hidro. Đặt A là công
thức hợp chất oxit cao nhất, B là công thức hợp chất khí với hidro của X. Khi đó tỉ khối hơi của A đối với B là 2,353. Xác định X, A, B. (ĐS: S, SO3 , H2 S)
CHƯƠNG II
Bài 10.Oxit cao nhất của nguyên tố R có công thức là RO3.Trong hợp chất khí của nguyên tố R với hidro, R chiếm 94,12% về khối lượng.
a) Xác định tên R
b) Nêu những tính chất cơ bản của R
c) So sánh tính phi kim của R với các nguyên tố lân cận
Bài 11.Hợp chất khí của nguyên tố X với H có dạng XH4. Oxit cao nhất của nó chứa 53,33% oxi về khối lượng
a) Xác định tên X
b) So sánh tính axit của oxit cao nhất và hidroxit tương ứng của X với các ngtố lân cận trong cùng chu kì.
Bài 12: Nguyên tố R là phi kim thuộc chu kì 2 của BTH. Hợp chất khí của R với hidro có công thức là RH2
.a) Xác định vị trí của R trong BTH
b) R phản ứng vừa đủ với 12,8g phi kim X thu được 25,6g XR2. Xác định tên nguyên tố X.
Bài13:
a) Viết cấu hình e, công thức hợp chất khí với hidro của các nguyên tố có số hiệu lần lượt là 7, 8, 9. Sắp xếp
các nguyên tố trên theo chiều tính phi kim tăng dần và giải thích
b) Cho 0,72g kim loại M thuộc nhóm IIA trong BTH tác dụng với HCl thu được 0,672 lit khí (đkc). Tìm kim
loại M. Viết cấu hình e nguyên tử, nêu vị trí trong BTH và so sánh tính chất hóa học của M với 19
K (giải thích)
Bài 14:
a) Cho 2 nguyên tố A, B đứng kế tiếp nhau trong BTH và có tổng số đơn vị điện tích hạt nhân là 37. Xác định A, B và cho biết TCHH đặc trưng của chúng.
b) Cho 8,8g hỗn hợp 2 kim loại nằm ở 2 chu kì liên tiếp và thuộc nhóm IIIA tác dụng với HCl dư thu được 6,72 lit khí (đkc). Xác định 2 kim loại đó.
Bài 15: Hòa tan 17,45g hỗn hợp 2 kim loại kiềm thuộc 2 chu kì liên tiếp trong bảng tuần hoàn bằng 400 ml dung dịch HCl 5,475% (D = 1,25g/ml) thu được dung dịch X và 6,16 lít khí (đktc).
a) Xác định 2 kim loại kiềm.
b) Tính nồng độ phần trăm các chất trong dung dịch X. (ĐS: Na, K; 2,83%, 4,32%; 1,41%)
Bài 16: Hòa tan 4,32g kim loại R bằng 350g dung dịch H2SO4 19,6% (D = 1,4g/ml) thu được dung dịch A và khí B. Cô cạn dung dịch A thu được 21,6g muối khan.
a) Xác định kim loại R.
b) Tính nồng độ mol/l các chất trong dung dịch A. (ĐS: Mg; 0,72M; 2,08M)
CHƯƠNG III + IV
Bài 17:Cho m gam KMnO4 tác dụng với HCl đặc thu được 3,36 lit Cl2 (đkc)
a) Viết PTHH xảy ra và cân bằng theo phương pháp thăng bằng e
b) Tính m. (ĐS: 9,g)
Bài 18: Cho 5,1g hỗn hợp gồm 2 kim loại Mg và Al tác dụng với H2SO4 đặc, nóng. Sau pư thu được hỗn hợp 2 muối và 5,6 lit khí SO2 (đkc).
a) Hoàn thành các PTPƯ xảy ra
b) Tính % khối lượng mỗi kim loại trong hỗn hợp. (ĐS: 47% ; 53%)
Bài 19: a) Hãy giải thích sự tạo thành liên kết cộng hóa trị trong phân tử Cl2, HBr bằng mô hình xen phủ các obitan nguyên tử
b) Cho biết loại liên kết trong các phân tử sau đây: NaCl, MgCl2 , AlCl3 , I2 , HCl, O2 , CH4
Bài 20:
a) Hãy cho biết điện hóa trị và cộng hóa trị của các nguyên tố trong các hợp chất sau: CaO, Al2O3 , NaCl,
CaCl2 , H2O, CH4 , HCl, NH3
b) Hãy giải thích sự tạo thành liên kết trong phân tử F2 , KCl, CH4 , CaO bằng cách góp chung hoặc nhường
nhận e
Bài 21:
a) Giải thích sự tạo thành liên kết trong phân tử CH4 , BCl3 , CO2 theo thuy ết lai hóa
b) Mô tả sự tạo thành liên kết  , liên kết
, liên kết  trong các hợp chất sau: C2H4, N2 , C2 H2
trong các hợp chất sau: C2H4, N2 , C2 H2
Bài 22: Hoàn thành các phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron.
a) NaClO + KI + H2SO4 ® I2 + NaCl + K2SO4 + H2O
b) Cr2O3 + KNO3 + KOH ® K2CrO4 + KNO2 + H2O
c) Al + Fe3O4 ® Al2O3 + Fe
d) FeS2 + O2 ® Fe2O3 + SO2
e) H2S + HClO3 ® HCl + H2SO4
f) NH3 + O2 ® NO + H2O
g) Fe + HNO3 ® Fe(NO3)3 + N2O + H2O
h) Cu + H2SO4 ® CuSO4 + SO2 + H2O
i) K2S + KMnO4 + H2SO4 ® S + H2SO4 + K2SO4 + H2O
j) Mg + HNO3 ® Mg(NO3)3 + NH4NO3 + H2O
k) CuS2 + HNO3 ® Cu(NO3)2 + H2SO4 + N2O + H2O
l) FeSO4 + Cl2 + H2SO4 ® Fe2(SO4)3 + HCl
m) KClO3 + NH3  KNO3 + KCl + Cl2↑ + H2O
KNO3 + KCl + Cl2↑ + H2O
n) Fe3O4 + HNO3 → Fe(NO3)3 + NxOy + H2O.
o) KNO3 + FeS2  KNO2 + Fe2O3 + SO3.
KNO2 + Fe2O3 + SO3.
p) FeO + HNO3 → NxOy↑ + Fe(NO3)3 + H2O.
q) : K2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
r) Al + HNO3 → Al(NO3)3 + NO + N2O + H2O.
s) Cu2S + HNO3 → Cu(NO3)2 + CuSO4 + NO + H2O
Bài 23.: Hòa tan hoàn toàn 3,22 gam hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lít hiđro (ở đktc) và dung dịch chứa m gam muối. Giá trị của m là
Câu 24: Hoà tan 5,6 gam Fe bằng dung dịch H2SO4 loãng (dư), thu được dung dịch X. Dung dịch X phản ứng vừa đủ với V ml dung dịch KMnO4 0,5M. Giá trị của V là (cho Fe=56)
Câu 25:Hòa tan hoàn toàn 12 gam hỗn hợp Fe, Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (ở đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là (cho N= 14, O = 16, Fe= 56, Cu = 64)
Câu 26: Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch HCl (dư), sau khi kết thúc phản ứng sinh ra 3,36 lít khí (ở đktc). Nếu cho m gam hỗn hợp X trên vào một lượng dư axit nitric (đặc, nguội), sau khi kết thúc phản ứng sinh ra 6,72 lít khí NO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là.

























 Trang Trước
Trang Trước



No comments: