Các Dạng Bài Tập Hóa Học Lớp 9
I. Lí thuyết cơ bản.
Câu 1: Lấy ví dụ về.
a. 1 pứ kim loại + axit . e. 1 pứ muối + muối
b. 1 pứ kim loại + H2O f, 1 pứ kim loại đứng trước đẩy kim loại
c. 1 pứ ôxit kim loại + axit. đứng sau ra khỏi dung dịch muối.
d. 1 pứ ôxit kim loại + H2O.
Câu 2: Cho các chất : Zn, Zn(OH)2, NaOH, CuSO4, NaCl, HCl. Hãy chọn những chất thích hợp để điền vào chỗ trống.
Câu 3: Cho các muối : Mg(NO3)2, CuCl2, cho biết muối nào có thể tác dụng với.
a. dd NaOH b. dd HCl c. dd AgNO3
nếu có hãy viết phương trình pư.
Giải:
Câu 3: + Cả (magie nitrat) Mg(NO3)2, (đồng clorua) CuCl2 đều tác dụng với NaOH tạo Mg(OH)2 và Cu(OH)2
và Cu(OH)2
+ Không muối nào tác dụng với HCl.
+ CuCl2 tác dụng với (bạc nitrat)AgNO3 tạo AgCl trắng.
trắng.
Câu 4: Ngâm đinh sắt trong dd dồng II sunfat (CuSO4). Hiện tượng gì xảy ra.
a. Không xuất hiện tượng.
b. Xuất hiện đồng màu đỏ bám trên đinh, đinh Fe không bị tan.
c. Xuất hiện đồng màu đỏ bám trên đinh, đinh Fe bị tan 1 phần, màu xanh của dd nhạt dần.
d. Không có Cu bám trên đinh Fe, chỉ 1 phần đinh bị tan.
Giải thích, viết phương trình.
Câu 4: Cho dd các chất sau phản ứng với nhau từng đôi một.
a. Ghi dấu (x) nếu có pứ xảy ra
b. Dấu (0) nếu không có.
c. Viết phương trình phản ứng nếu có.
NaOH | HCl | H2SO4 | |
CuSO4 | |||
HCl | |||
Ba(OH)2 |
Câu 5: Viết ptpứ cho những chuyển đổi hóa học sau.
a. B.
Fe2O3 Cu(OH)2↓
Câu 6: Cho biết hiện tượng xảy ra khi cho.
a. Kẽm (Zn) vào dd đồng sunfat (CuSO4) b. Đồng (Cu) vào dd bạc nitrat (AgNO3)
c. Kẽm (Zn) vào dd magiê clorua (MgCl2) c. Nhôm (Al) vào dd đồng sunfat (CuSO4)
viết ptpứ xảy ra.
Câu 7: Axit H2SO4 loãng pứ với tất cả các chất nào dưới đây.
a. FeCl3, MgO, Cu, Ca(OH)2 b. NaOH, CuO, Ag, Zn.
b. Mg(OH)2, HgO, K2SO4, NaCl d. Al, Al2O3, Fe(OH)3, BaCl2
Câu 8: Cho các chất Na2O, CaO, H2O, CuCl2, FeCl3. điều chế các.
a. Dd bazơ (bazơ tan) b. Các bazơ không tan.
Câu 9. Viết ptpứ của
a. Magiê oxit (MgO) và axit nitric (HNO3). b. Nhôm oxit (Al2O3) và axit sunfuric (H2SO4)
c. Sắt (Fe) và axit clohidric (HCl) d. Kẽm (Zn) và axit sunfuric loãng.
II. Bài tập cơ bản

 1. ÁP DỤNG CÔNG THỨC
1. ÁP DỤNG CÔNG THỨC  n: số mol
n: số mol
m: khối lượng cho trước (gam)
M: khối lượng phân tử
Câu 1: Cho 1,68 gam Fe tác dụng hết với dd đồng(II)sunfat (CuSO4) dư, tính khối lượng Cu thu được sau pứ.
Giải:
Số mol
Vậy khối lượng kim loại  là 1,92 gam
là 1,92 gam
Câu 2: Cho 0,8 gam (natri hidroxit) NaOH tác dụng với dd H2SO4 dư, cô cạn dd sau pứ thu được bao nhiêu gam muối khan.
Giải.
Số mol
Vậy khối lượng muối  khan là 1,42 gam
khan là 1,42 gam
Câu 3. Cho 1,6 gam CuO tác dụng hết với HCl dư. Cô cạn dd sau pứ thu được bao nhiêu gam muối khan.
Giải.
Số mol
Vậy khối lượng muối  khan là 2,7 gam
khan là 2,7 gam
Câu 4: Cho dd chứa m gam BaCl2 tác dụng với dd H2SO4 dư tạo thành 4,66gam kết tủa. Tính m.
Giải:
Số mol
Câu 5: Cho 1,2 gam Mg tác dụng hoàn toàn với dd AgNO3 dư. Tính khối lượng Ag sinh ra.
(đ/s: 10,8 gam).
Câu 6: Cho dd chứa 4,25 gam AgNO3 tác dụng hoàn toàn với NaCl dư. Tính khối lượng kết tủa tạo thành.
(đ/s: 3,5875 gam)
Câu 7: Cho m gam kim loại Ca tác dụng với H2O dư sinh ra 0,03gam khí H2. tính m?
(đ/s: 0,6gam)
Câu 8: Cho m gam Na2O tác dụng hoàn toàn với dd H2SO4 dư, sau pứ cô cạn dd thu được 2,84 gam muối khan, tính m.
(đ/s: 1,24 gam)
Câu 9: Cho 2,74 gam Ba hòa tan hoàn toàn vào H2O tạo thành dd X.
a. Tính khối lượng H2 tạo thành.(đ/s: 0,04 gam)
b. Cho dd X pứ với dd H2SO4 dư. Tính số gam kết tủa tạo thành.(đ/s: 4,66 gam)

 2. ÁP DỤNG CÔNG THỨC
2. ÁP DỤNG CÔNG THỨC  n: số mol
n: số mol
(chỉ áp dụng cho chất khí) V: thể tích chất khí.
Câu 1: Cho 0,557 gam (natri) Na tác dụng với H2O dư, thoát ra V lít khí, tính V.
Giải:
Số mol
Vậy V=0,28 lit
Câu 2: Cho 0,45 gam Al tác dụng hoàn toàn với (axit sunfuric) H2SO4 dư thu được V lit khí. Tính V.
Giải:
Số mol
Vậy V=0,672 lit
Câu 3: Cho m gam (sắt) Fe phản ứng với dd HCl dư thu được 0,336 lit khí H2 (đktc) tính m.
(đktc) tính m.
Giải:
Vậy m = 0,84gam
Câu 4: Cho 3g hỗn hợp gồm (magie) Mg và (đồng) Cu tác dụng với dd HCl dư thoát ra 1,568lit khí H2 (đktc). Tính khối lượng Mg và Cu trong hỗn hợp.
(đktc). Tính khối lượng Mg và Cu trong hỗn hợp.
Giải:
Cho Mg và Cu vào HCl thì chỉ có Mg pứ (Cu ko Pứ vì Cu đứng sau H trong dãy điện hóa)
Câu 5: Cho 1,3 gam (kẽm) Zn tác dụng hoàn toàn với (axit sunfuric) H2SO4 dư thu đc V lit khí. Tính V.
(đ/s: 0,448lit)
Câu 6: Cho 0,84 gam (magie) Mg tác dụng hoàn toàn với HCl dư thu được V lit khí. Tính V.
(đ/s: 0,784lit)
Câu 7: Cho m gam (sắt) Fe phản ứng với dd H2SO4 dư thu được 1,12 lit khí H2 (đktc) tính m.
(đktc) tính m.
(đ/s: 2,8 gam)
Câu 8: Cho 0,6g hỗn hợp gồm Al và Cu tác dụng với dd HCl (axit clohidric) dư thoát ra 0,336lit khí H2 (đktc). Tính khối lượng Al và Cu trong hỗn hợp.
(đktc). Tính khối lượng Al và Cu trong hỗn hợp.
(đ/s: 0,27g Al và 0,33g Cu)
Câu 8: Cho 1,5g hỗn hợp gồm Fe và Ag tác dụng với dd HCl dư thoát ra 0,336lit khí H2 (đktc). Tính khối lượng Fe và Ag trong hỗn hợp.
(đktc). Tính khối lượng Fe và Ag trong hỗn hợp.
(đ/s: 0,84g Fe và 0,66g Ag)
3. ÁP DỤNG CÔNG THỨC  n: số mol
n: số mol
V: thể tích dung dịch
(chỉ áp dụng cho dung dịch chất lỏng)
Câu 1: Cho 0,5 gam (canxi) Ca vào 500ml H2O, tính nồng độ dd Ca(OH)2 thu được sau pứ.
Giải:
Số mol
Số mol Ca(OH)2 tạo thành
Thể tích dd :
Nồng độ dd Ca(OH)2
Câu 2: Cho 10g CuO tác dụng hoàn toàn với dd 500ml dd (axit clohidric) HCl dư. Tính nồng độ dd CuCl2 tạo thành?
Giải:
Pt:
Thể tích dd :
Câu 3: Cho m gam (sắt ôxit) FeO tác dụng hết với 600ml dd HCl (axit clohidric) đặc tạo thành dd (sắt clorua) FeCl2 0,2M. Tính m?
Nồng độ FeCl2: CM=0,2M thể tích dd: Vdd = 600ml = 0,6lit
Pt:
Câu 4: Cho 300 ml dd H2SO4 0,1M tác dụng hết với Al tạo thành (muối nhôm sunfat) Al2(SO4)3. tính nồng độ của dd Al2(SO4)3 trên?
Giải:
Câu 5: Cho 2,35 gam (kali ôxit ) K2O vào 400ml H2O. tính nồng độ dd KOH (kali hidroxit) thu được.
(đs: 0,125M)
Câu 6: Cho 1,11g Ca(OH)2 tác dụng hoàn toàn với 500ml dd HCl. tính nồng độ dd CaCl2 thu được.
(đs: 0,03M)
Câu 7: Cho m gam (nhôm ôxit) Al2O3 tác dụng hoàn toàn với 600ml dd H2SO4 tạo thành dd Al2(SO4)3 (nhôm sunfat) 0,05M. Tính m? (đ/s: 3,06 g)
Câu 8: Cho mg NaOH tác dụng hoàn toàn với 400 ml dd HCl tạo thành dd NaCl 0,15M. tính m.
(đ/s: 2,4g)
Câu 9: Cho m gam Ca pứ hoàn toàn với 500ml H2O tạo thành 2,24lit khí.
a. Tính m.
b. Tính nồng độ dd Ca(OH)2 tạo thành.
(đs: câu a: 4gam; câu b: 0,2M)
4. Áp dụng công thức (1) ( : khối lượng chất tan
: khối lượng chất tan
Khối lượng riêng  (2) (m: khối lượng)
(2) (m: khối lượng)
(V: thể tích dung dịch)
(d: khối lượng riêng của dd)
(chỉ áp dụng cho dung dịch chất lỏng)
Câu 1: cho 1,68g (canxi ôxit) CaO hòa tan hoàn trong 300g H2O. tính nồng độ phần trăm (C%) của dd thu được.
Giải:
Vậy khối lượng Ca(OH)2 tạo thành: 
Vậy mct = 2,22 gam
Vậy nồng độ phần trăm Ca(OH)2: 
Câu 2: Cho 12 gam đồng ôxit (CuO) tác dụng hết với 200ml dd H2SO4, khối lượng riêng 1,98g/ml. tính nồng độ C% của dd thu được.
Giải:
+ Khối lượng riêng  khối lượng dd H2SO4 là
khối lượng dd H2SO4 là 
Vậy khối lượng chất tan: mct = 24 gam
Câu 3: Cho 22,2 g (canxi clorua) CaCl2 pứ với 200ml dd Na2SO4 dư (d=1,55g/ml) tính nồng độ phần trăm (c%) của dd muối thu được.
Giải:
Số mol

 (*) (vì
(*) (vì kết tủa và bị vớt ra làm khối lượng dd giảm)
kết tủa và bị vớt ra làm khối lượng dd giảm)
Vậy nồng độ phần trăm dd muối NaCl : 
Câu 4: Cho 200g dd H2SO4, 14,% tác dụng với Al dư. Tính khối lượng muối Al2(SO4)3 thu được?
Giải:
Pt:
Số mol:
Khối lượng
Câu 5: Cho 2,4 gam Fe2O3 hòa tan trong 300g dd H2SO4 dư. Tính nồng độ c% của dd muối thu được?
Câu 6: Cho 4,64g Ag2O tác dụng hết với 300ml dd HNO3 khối lượng riêng d=1,59g/ml tính nồng độ c% của dd muối thu được.
Câu 7: Cho 16,8g AgNO3 pứ với 300ml dd BaCl2 dư (khối lượng riêng d= 1,33g/ml). tính khối lượng riêng của dung dịch muối tạo thành.
Câu 8: Cho 73 gam dd HCl 20% tác dụng hết với CuO dư. Tính khối lượng muối thu được.
III. Bài tập củng cố
IV: BÀI TẬP CỦNG CỐ (tiếp theo)
1. LÍ THUYẾT
Câu 1: Viết phương trình hóa học biểu diễn chuyển hóa sau đây.
c. ![]()
gợi ý: câu 5a: ![]() (dpnc: điện phân nóng chảy)
(dpnc: điện phân nóng chảy)
Câu 2: có các chất sau: CuO, Mg, Al2O3, Fe(OH)3, Fe2O3. hãy chọn một trong những chất đã cho tác dụng với HCl sinh ra:
a. Khí nhẹ hơn không khí và cháy được trong không khí.
b. dd có màu xanh lam.
c. dd có màu vàng nâu.
d. dd không có màu.
Viết các ptpứ .
Câu 4: Cho các chất sau phản ứng với nhau từng đôi một.
a. Ghi dấu (x) nếu có pứ xảy ra
b. Dấu (0) nếu không có.
c. Viết phương trình phản ứng nếu có.
H2SO4 | Fe | NaCl | CaCl2 | |
AgNO3 | ||||
HNO3 loãng | ||||
CuSO4 | ||||
Zn |
Câu 5: Viết ptpứ của Mg, MgO, Fe, FeO, Fe2O3, với HNO3 loãng.
Nêu hiện tượng của pứ.
2, BÀI TẬP
Câu 1: Ngâm bột sắt dư trong 10ml dd đồng sunfat 1M. sau khi phản ứng kết thúc, lọc thu được chất rắn A và dd B.
a. Cho A tác dụng với dd HCl dư. Tính khối lượng chất rắn còn lại sau pứ.
b. Tính thể tích dd NaOH 1M vừa đủ để kết tủa hoàn toàn dd B.
(đ/s: a.0,64g b. 0,02lit)
Câu 2: Cho 10,2gam Al2O3 hòa tan trong 300g dd H2SO4 dư. Tính nồng độ c% của dd muối thu được?
(đ/s: 11,025%)
Câu 3: Cho 122,5 gam dd H2SO4 40% tác dụng hết với CuO dư. Tính khối lượng muối thu được.
(đ/s:80gam)
Câu 4: Cho 1,96 g bột sắt vào 100ml dd CuSO4 10% có khối lượng riêng là 1,12g/ml.
a. Viết ptpứ.
b. Xác định nồng độ mol/lit của các chất trong dd sau khi pứ kết thúc.
c. Cô cạn dd thu được bao nhiêu gam muối khan.
(đ/s: b.![]()
![]() c.10,92gam)
c.10,92gam)
 Câu 5: Nguyên tắc để sản xuất gang, thép trong luyện kim là phản ứng khử oxit sắt trong quặng sắt thành sắt:
Câu 5: Nguyên tắc để sản xuất gang, thép trong luyện kim là phản ứng khử oxit sắt trong quặng sắt thành sắt:
a. Tính khối lượng sắt thu được khi khử hoàn toàn 4,64gam Fe2O3.
b. Hòa tan lượng sắt thu được vào 500ml dung dịch H2SO4 loãng có nồng độ 0,1M. Sau khi pứ xảy ra hoàn toàn, thì chất nào hết, chất nào dư.
- Tính thể tích khí thoát ra (đktc)
- Tính nồng độ mol/lit của các chất còn lại sau pứ.
- Cô cạn dd sau pứ thu được bao nhiêu gam muối khan.
(đ/s: a. 2,24gam b.-sắt hết -H2SO4 0,02M FeSO4 0,08M. -6,08gam)
Câu 6: Cho 2,7 gam Al phản ứng với 200ml dd FeSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, cho biết.
A. Chất nào hết, chất nào dư?
b. Tính khối lượng Fe thu được (giả sử toàn bộ lượng Fe thu được đều bám trên thanh Al)
c. Dung dịch sau phản ứng gồm những chất nào. Tính nồng độ từng chất trong dung dịch.
(đ/s: Al hết, FeSO4 dư b. 8,4 gam c. Al2(SO4)3: 0,25M FeSO4 0,25M)
Câu 7: Cho 3g hỗn hợp gồm magie và đồng tác dụng với dd HCl dư thoát ra 1,568lit khí H2 (đktc). Tính % khối lượng Mg và Cu trong hỗn hợp.
(đktc). Tính % khối lượng Mg và Cu trong hỗn hợp.
Giải:
Cho Mg và Cu vào HCl thì chỉ có Mg pứ (Cu ko Pứ vì Cu đứng sau H trong dãy điện hóa)

Vậy % khối lượng Mg:
Vậy % khối lượng Cu:
Hoặc % khối lượng Cu: =100% -56% = 44%
Câu 8: Cho 1,5g hỗn hợp gồm Fe và Ag tác dụng với dd HCl dư thoát ra 0,336lit khí H2 (đktc). Tính % khối lượng Fe và Ag trong hỗn hợp.
(đktc). Tính % khối lượng Fe và Ag trong hỗn hợp.
(đ/s: %Fe=56% và %Ag=44%)
Câu 9: Ngâm 1 lá sắt có khối lượng 28gam trong dung dịch đồng sunfat dư. Sau một thời gian lấy lá kẽm ra khỏi dd muối CuSO4 và đem cân thấy khối lượng của lá là 29,6 gam.
a. Viết ptpứ.
b. Tính khối lượng sắt đã tham gia pứ và khối lượng đồng tạo thành.
c. Tính phần trăm khối lượng của sắt và đồng trong lá trên.
d. Đem hòa tan 23 gam lá trên vào dd HCl dư. Tính thể tích khí thoát ra (đktc).
e. Đem hòa tan 23 gam lá trên vào dd HNO3 đặc dư. Tính thể tích khí thoát ra (đktc).
Giải:
a. Phương trình: ![]()
b. Gọi số mol sắt tham gia pứ là x ta có.
![]()
![]()
Khối lượng của Fe tan ra: ![]()
Khối lượng của Cu bám vào: ![]()
Khối lượng lá sắt tăng = 29,4 – 28 = 1,6(gam)
Mà khối lượng lá sắt tăng = Khối lượng của Cu bám vào - Khối lượng của Fe tan ra

Vậy:
![]()
Vậy Khối lượng của Fe tan ra: ![]()
Khối lượng của Cu bám vào: ![]()
c. Khối lượng của Fe còn lại trong lá là : ![]()
khối lượng của đồng bám trong lá là : ![]()
 Vậy phần trăm khối lượng sắt:
Vậy phần trăm khối lượng sắt:
Phần trăm khối lượng của Cu:
d. (đ/s: 6,72 lit)
e. (đ/s: 29,12lit)
Câu 10: Ngâm 1 lá magie có khối lượng 24gam trong dung dịch sắt (II) clorura dư. Sau một thời gian lấy lá kẽm ra khỏi dd muối FeCl2 và đem cân thấy khối lượng của lá là 36,8 gam.
a. Viết ptpứ.
b. Tính khối lượng magie đã tham gia pứ và khối lượng sắt tạo thành.
c. Tính phần trăm khối lượng của magie và sắt trong lá trên.
d. Đem hòa tan 36,8 gam lá trên vào dd HCl dư. Tính thể tích khí thoát ra (đktc)
e. Đem hòa tan 36,8 gam lá trên vào dd HNO3 đặc dư. Tính thể tích khí thoát ra (đktc)
(đ/s: b.9,6g Mg 22,4gam Fe c. 39,13%Mg 60,87%Fe d. 22,4lit c.53,76lit)
Câu 11: Ngâm 1 lá sắt có khối lượng 2,5gam trong 25ml dd CuSO4 15% có khối lượng riêng 1,12g/ml. Sau một thời gian phản ứng. Người ta lấy lá sắt ấy ra khỏi dung dịch và làm khô thì cân nặng 2,85 gam.
a. Viết ptpứ.
b. Tính nồng độ phần trăm của dd sau pứ.
(đ/s: C% CuSO4 dư = 9,31% C%(FeSO4 =5,44%)
TRẮC NGHIỆM Câu 1. Dung dịch NaOH phản ứng với tất cả các chất trong dãy nào sau đây? a. FeCl3,MgCl2,CuO,HNO3 b. H2SO4,SO2,CO2,FeCl2 c. HNO3,HCl, CuSO4, KNO3 d. Al, MgO, H3PO4,BaCl2 Câu 2. Dãy các kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hoá học tăng dần? a. K, Mg, Cu, Al, Zn b. Cu, K, Mg, Al, Zn c. Cu, Zn, Al, Mg, K d. Mg, Cu, K, Al, Zn Câu 3. Axit H2SO4 loãng phản ứng với tất cả các chất trong dãy chất nào sau đây? Viết ptpứ a. FeCl3, MgO, Cu, Ca(OH)2 b. NaOH,CuO,Ag,Zn c. Mg(OH)2,CaO, K2SO4,NaCl d. Al,Al2O3,Fe(OH)2,BaCl2 Câu 4. Kim loại nào hay được dùng làm đồ trang sức? a. Cu, Al b. Au, Ag c. Cu, Fe d. Ag, Al Câu 5. Phân nào là phân urê? a. (NH4)2SO4 b. NH4NO3 c. Ca(NO3)2 d. CO(NH2)2 Câu 6. Kim loại nào sau đây không tác dụng với axit H2SO4 loãng? a. Fe b. Zn c. Cu d. Mg Câu 7. Những kim loại nào sau đây tác dụng được với dung dịch HCl: a. Cu, Zn, Fe b. Al, Cu, Hg c. Zn, Fe, Mg d. Cu,Ag, Al. Câu 8. Oxit nào sau đây là oxit bazơ (oxit kim loại). a. MgO, FeO, SO2 b. MgO, FeO, Na2O. c. MgO, P2O5, K2O d. SO2, CO2, P2O5. Câu 9. Chất nào sau đây làm quì tím chuyển thành màu đỏ? a. Dung dịch NaOH c. ZnO B. Dung dịch HNO3 d. KCl Câu 10. Dãy gồm bazơ không tan là. a. Fe(OH)2,Mg(OH)2 b. KOH,Cu(OH)2 c. KOH,NaOH d. Ba(OH)2, Fe(OH)2 Câu 11. Các dãy sau, dãy nào toàn là muối tan? a. NaCl, Fe(NO3)3, ZnSO4 b. CaCO3, AgCl, NaNO3 c. CaCO3, AgCl, BaSO4 d. NaOH, HNO3, AgCl Câu 12. Dãy gồm các muối không tan là? a. AgCl, CaCO3, BaSO4 b. AgCl, NaNO3, NaCl c. BaSO4, NaCl, Zn(NO3)2 d. NaCl, FeCl3, Mg(NO3)2 Câu 13. Thuốc thử nào sau đây phân biệt dung dịch Na2SO4 và dung dịch NaNO3: a. Dung dịch HCl b. Dung dịch AgNO3 c. Dung dịch ZnSO4 d. Dung dịch BaCl2 Câu 14. Các muối tan là: a. CaCO3, BaCl2 b. NaCl, KNO3 c. CuCl2, AgCl d. BaSO4,CaCO3 TỰ LUẬN Câu 1. Tiếp tục lấy ví dụ về. a. 1 pứ kim loại + axit . e. 1 pứ muối + muối b. 1 pứ kim loại + H2O f, 1 pứ kim loại + muối. c. 1 pứ ôxit kim loại + axit. d. 1 pứ ôxit kim loại + H2O. Câu 2. Viết các phương trình hoa học của các Phản ứng xảy ra giữa các cặp chất sau đây: a. Kẽm + Axit sunfuric loãng b. Kẽm + dung dịch Bạc nitrat c. Natri + Lưu huỳnh d. Canxi + Clo e. Kali + lưu huỳnh f. Kẽm + oxi | Câu 3. Dự đoán hiện tượng và viết PTHH khi: a. Đốt dây sắt trong khí Clo b. Cho một đinh sắt vào ống nghiệm đựng dung dịch CuCl2 c. Cho một viên kẽm vào dung dịch CuSO4 Câu 4. Viết các PTPỨ giữa? a. Kẽm + Axit sunfuric b. Kẽm + Dung dịch Bạc Nitrat c. Natri + oxi d. Canxi + clo Câu 5. Hãy cho biết hiện tượng và viết PT xảy ra khi cho: a. Kẽm vào dung dịch đồng clorua b. Đồng vào dung dịch Bạc nitrat c. Kẽm vào dung dịch Magiê Clorua d. Nhôm vào dung dịch đồng clorua Câu 6. Dựa vào tính chất hoá học của kim loại, hãy viết các phương trình hoá học sau đây:
Câu 7. Có 3 kim loại là nhôm, bạc, sắt. Nêu pp hoá học để nhận biết từng kim loại. Viết các PTPỨ để nhận biết. Câu 8. Trộn lẫn các dung dịch sau. a. Kali clorua + bạc nitrat d. Sắt(II) sunfat + natri clorua b. Nhôm sunfat + bari nitrat. e. Natri nitrat + đồng sunfat c. Kalicacbonat + axit sunfuric f. Natri sunfua + axit clohidric Nêu hiện tượng xảy ra. Giải thích bằng PTPƯ. Câu 9. Viết 5 PTHH khác nhau để thực hiện phản ứng. BaCl2 + ? Câu 10. Gọi tên các hợp chất Bazơ sau: NaOH, Ca(OH)2, KOH, Mg(OH)2, Al(OH)3, Fe(OH)2, Cu(OH)2 Trong các bazơ trên, bazơ nào không tan trong nước. Câu 11. Gọi tên các muối sau: CuSO4, AgNO3, BaCl2, Ca3(PO4)2, FeCO3, NaHSO4, Ca(HCO3)2 Trong các muối trên, muối nào không tan trong nước. Câu 12. Có dung dịch muối AlCl3 lẫn tạp chất là CuCl2. Có thể dùng chất nào sau đây để là sạch muối Nhôm? Giải thích và viết phương trình hoá học a. AgNO3 b. HCl c. Mg d. Al e. Zn Câu 13. Hãy viết phương trình hoá học theo các sơ đồ phản ứng sau đây:
Câu 14. Bằng phương pháp hoá học hãy tách từng kim loại Al, Fe, Cu ra khỏi hỗn hợp 3 kim loại. Câu 15. Lấy ví dụ về 2 pứ muối tác dụng với bazơ. Rút ra kết luận: Muối tác dụng với bazơ sản phẩm sinh ra là:….. Nêu điều kiện xảy ra pứ. a. Hai muối mới b. Muối mới và axít mới c. Muối và nước d. Muối mới và bazơ mới Câu 16. Cặp chất nào phản ứng được với nhau? Viết pt. a. Cu(OH)2 và NaCl b. NaCl và H2SO4 c. NaCl và AgNO3 d. KOH và Na2CO3 |
V. LÍ THUYẾT THÊM NỮA
VI: GIẢI BÀI TẬP BẰNG CÁCH LẬP HỆ PHƯƠNG TRÌNH
 + Áp dụng cho bài toán có hỗn hợp 2 chất hoặc nhiều chất
+ Áp dụng cho bài toán có hỗn hợp 2 chất hoặc nhiều chất
+Câu 1: cho 18,6gam hỗn hợp gồm sắt và kẽm tác dụng với dd HCl dư thu được 6,72lit khí H2 (đktc), tính khối lượng mỗi kim loại trong hỗn hợp. Giải:
số mol khí H2↑: * Gọi số mol của Fe và Zn trong hỗn hợp lần lượt là x và y mol ta có: 56.x + 65.y = 18,6 g (1) * Thay vào phương trình.
* Số mol H2 tạo thành là 0,3 vậy: (2) * Từ 1 và 2 ta có hệ phương trình
Vậy: số mol Fe: →khối lượng Fe: Vây: số mol Zn: →khối lượng Zn: Câu 2: Cho 3,75g hỗn hợp gồm nhôm và magie tác dụng với dd H2SO4 loãng dư thu được 3,92lit khí H2 (đktc) a. viết pt. b. Tính khối lượng mỗi kim loại trong hỗn hợp. (đ/s: 1,35g Al, 2,4g Mg) Câu 3: Cho 0,83g hỗn hợp gồm nhôm và sắt tác dụng với dd H2SO4 loãng dư thu được 0,56l khí H2 (đktc). a. viết pt b. tính phần trăm khối lượng mỗi kim loại trong hỗn hợp. (đ/s: %mAl=32,53% %mFe=67,47%) Câu 4 (*): Cho 1g hỗn hợp gồm đồng và sắt tác dụng với dd H2SO4 loãng dư thu được 0,224lit khí H2 (đktc). a.viết pt b. tính phần trăm khối lượng mỗi kim loại trong hỗn hợp. (đ/s: %mCu=44% %mFe=56%) +Câu 5: Cho 56 g hỗn hợp gồm CuO và Fe2O3 tác dụng với dd H2SO4 dư. Sau pứ cô cạn dd thu được 136 g muối khan. a. Viết ptpứ. b. Các muối tạo thành có tan không. c. Tính khối lượng mỗi oxit trong hỗn hợp. Giải: (câu a và b tự làm) c. Gọi số mol của CuO và Fe2O3 trong hỗn hợp lần lượt là x và y mol ta có: 80.x + 160.y = 56 g (1)
Câu 9 *: Cho 9,2 gam hỗn hợp kim loại Fe và Cu tác dụng với dd H2SO4 loãng dư thu được 1,12lit khí (ở đktc). a. viết pt b. khi cô cạn dd thu được bao nhiêu gam muối khan. (đ/s: 7,6g) Câu 10: hòa tan hoàn toàn 12,1 g hỗn hợp bột CuO và ZnO cần 100ml dd HCl 3M a. Viết ptpứ. b. Tính % khối lượng mỗi oxit trong hỗn hợp ban đầu. c. Tính khối lượng dd H2SO4 có nồng độ 20% để hòa tan hoàn toàn hỗn hợp oxit trên. (đ/s: a. %mCuO=33% %mZnO=67% b. 73,5g) Câu 11: Cho 15,25 g hỗn hợp gồm nhôm và sắt phản ứng hoàn toàn với dd CuSO4 dư, tạo thành 27,2 g Cu↓. a. Viết ptpứ, nêu hiện tượng của pứ. b. Tính % khối lượng của nhôm và sắt trong hỗn hợp. (đ/s: 26,56% Al 73,44% Fe) + Câu 12: Cho m gam hỗn hợp 2 kim loại Mg và Fe tác dụng với dd HCl dư thu được 5,6lit khí (đktc). Mặt khác cho m gam trên tác dụng với dd HNO3 loãng thì thu được 4,48lit khí (đktc). a. Viết các ptpứ xảy ra. b. Tính m. giải: a. Ptpứ - Cho Mg và Fe tác dụng với HCl:
- Cho Mg và Fe tác dụng với HNO3 loãng:
b. Gọi số mol của Mg và Fe trong mg hỗn hợp lần lượt là x và y mol ta có: - Cho hỗn hợp tác dụng với HCl thì xảy ra các pứ.
2 pứ tạo thành 5,6lit khí H2↑: vậy Vậy: x + y = 0,25 (1) - Cho hỗn hợp tác dụng với HNO3 thì xảy ra các pứ.
2 pứ tạo thành 4,48lit khí NO↑:vậy Vậy: * Từ 1 và 2 ta có hệ phương trình
* Khối lượng đồng
(Nhận xét: bài toán cho 3 dữ kiện vì vậy có thể tìm được 3 ẩn là số mol của 3 kim loại) Câu 17: Hỗn hợp gồm Mg, Fe, Ag nặng 22 gam được hoà tan bằng axit H2SO4 dư thoát ra 7,84 lit khí (đktc) và nhận được dung dịch A cùng 7,2 gam chất rắn B a. viết ptpứ. b. Tính % khối lượng mỗi kim loại. c. Cho 22 gam chất rắn trên tác dụng với dd HNO3 đặc dư. Tính thể tích khí thoát ra (đktc). (đ/s:b.%mMg=16,36%,%mFe=50,91%,%mAg=32,73%c.17,17lit) Câu 18: cho 37,2 gam hỗn hợp gồm Fe, FeO, Fe2O3 hòa tan hoàn toàn trong HNO3 đặc dư thu được 24,64 lit khí (đktc). Cô cạn dd thu được 169,4 gam muối khan. a. viết ptpứ. b. tính khối lượng mỗi chất trong hỗn hợp. (đ/s: 16,8gFe 14,4gFeO 16gFe2O3) Câu 10 *: Hỗn hợp gồm Al, Al2O3 và Cu nặng 10 gam. Nếu hoà tan hoàn toàn hỗn hợp bằng axit HCl dư giải phóng 3,36 lit khí (đktc), nhận được dd B và 2,75 gam chất rắn A. a. Viết ptpứ. b. tính % khối lượng mỗi chất ban đầu. | Vậy klượng CuSO4 tạo thành Vậy klượng Fe2(SO4)3 tạo thành * Tổng khối lượng muối khan tạo thành là 136g vậy:
* Từ (1) và (2) ta có hệ phương trình.
Vậy: số mol CuO: →khối lượng CuO: Vây: số mol Fe2O3: →khối lượng Fe2O3: Câu 6: Cho 40,1 g hỗn hợp gồm Na2O và BaO tác dụng với dd HCl dư. Sau pứ cô cạn dd thu được 67,6 g muối khan. a. Viết pt b. Tính khối lượng mỗi oxit trong hỗn hợp. (đ/s: 24,8g Na2O 15,39g BaO) + Câu 7: Cho 7,8 gam hỗn hợp kim loại Al và Mg tác dụng với HCl thu được 8,96 lít H2 (ở đktc). Hỏi khi cô cạn dung dịch thu được bao nhiêu gam muối khan.
Số mol H2 thu được là: * Gọi số mol của Al và Mg trong hỗn hợp lần lượt là x và y mol ta có: 27.x + 24.y = 7,8 g (1) * Thay vào phương trình.
* Số mol H2 tạo thành là 0,4 vậy: (2) * Từ 1 và 2 ta có hệ phương trình
* Vậy: số mol Al:
→khối lượng muối AlCl3: * Vậy: số mol Mg:
→khối lượng muối MgCl2: →cô cạn dd thu được khối lượng muối khan là: = Câu 8: Cho 9,2 gam hỗn hợp kim loại Fe và Cu tác dụng với dd HNO3 đặc dư thu được 7,84lit khí (ở đktc). a. Viết pt. b. Hỏi khi cô cạn dd thu được bao nhiêu gam muối khan. (đ/s: 30,9g) →Số mol Mg =0,15 vậy khối lượng Mg: →Số mol Fe =0,15 vậy khối lượng Fe:
→vậy m = mMg + mFe = 3,6 + 5,6 = 9,2 gam Câu 13: Cho m gam hỗn hợp 2 kim loại Zn và Al tác dụng với dd H2SO4 loãng dư thu được 10,08lit khí (đktc). Mặt khác cho m gam trên tác dụng với dd HNO3 đặc thì thu được 20,16lit khí (đktc). a. Viết các ptpứ xảy ra. b. Tính m. (đ/s: 15,15g) Câu 14*: Cho m gam hỗn hợp 2 kim loại Cu và Al tác dụng với dd H2SO4 loãng dư thu được 16,8lit khí (đktc). Mặt khác cho m gam trên tác dụng với dd HNO3 đặc thì thu được 44,8lit khí (đktc). a. Viết các ptpứ xảy ra. b. Tính m. (đ/s: 29,5g) Câu 15: 200 ml dung dịch HCl 3,5M hoà tan vừa hết 20gam hỗn hợp hai oxit CuO và Fe2O3 a. Viết các PTHH. b. Tính khối lượng mỗi oxit có trong hỗn hợp ban đầu (đ/s:mCuO=4gam mFe2O3=16gam) +Câu 17: Hỗn hợp gồm Al, Mg, Cu nặng 20 gam được hoà tan bằng axit HCl dư thoát ra 17,92 lit khí (đktc) và nhận được dung dịch A cùng 4,4 gam chất rắn B a. viết ptpứ. b. Tính % khối lượng mỗi kim loại.
*Khí thoát ra là H2↑ : số mol là *Cho hỗn hợp Al, Mg, Cu tác dụng với HCl chỉ có Al, Mg tác dụng còn Cu không tác dụng. vậy chất rắn B còn lại là Cu. Khối lượng đồng * Vậy tổng khối lượng Al, Mg là 20 – 4,4 = 15,6gam * Gọi số mol của Al và Mg trong hỗn hợp lần lượt là x và y mol ta có: 27.x + 24.y = 15,6 g (1) * Thay vào phương trình.
* Số mol H2 tạo thành là 0,8 vậy: (2) * Từ 1 và 2 ta có hệ phương trình
* Vậy: số mol Al: →khối lượng: * Vậy: số mol Mg: →khối lượng: | ||||||||||||




































































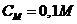













































 Trang Trước
Trang Trước





mấy bài này hình như là của lớp 8 mà sao nó dễ vậy bạn
ReplyDeleteBài dễ quá
ReplyDeleteThis comment has been removed by a blog administrator.
ReplyDeletehhhh
ReplyDeletecho cái bài nào khó hơn tí đi
ReplyDeleteđốt cháy hoàn toàn 0.3 mol hỗn hợp khí gổm CH4 và C2H4 lấy toàn bộ khí CO2 sinh ra cho vào dubg dịch Ca(OH)2 dư thu được 40 g kết tủa. tính % thể tích của mỗi khí có trong hỗn hợp đầu
Deleteoh, no
DeleteĐốt cháy 28ml hỗn hợp khí metan và axetilen cần phải dùng 67.2ml khí oxi
ReplyDeleteA)tính %V của mỗi khí trong hỗn hợp
B)Tính Vco2 sinh ra